
硝酸铵 | 过氧化钠 高锰酸钾 氯酸钾 |
钠 钙 过氧化氢 | 氧化钠 |
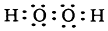
分析 (1)双氧水过氧化氢是只有共价键形成的共价化合物,根据共价键的特点书写电子式;
(2)根据化合价升降确定氧化还原反应以及氧化剂、还原剂;
(3)硝酸铵会发生爆炸,生成氮气、二氧化氮和水蒸气,根据质量守恒书写化学方程式结合反应热和方程式系数之间的关系书写热化学方程式;
(4)酸性高锰酸钾溶液具有强的氧化性,可以氧化过氧化氢据此书写;
(5)用双氧水处理氰化钠,产生一种有刺激性气味的气体为氨气,根据原子守恒一种酸式盐为碳酸氢钠,根据方程式计算即可.
解答 解:(1)双氧水过氧化氢是只有共价键形成的共价化合物,电子式为: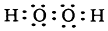 ,故答案为:
,故答案为: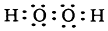 ;
;
(2)过氧化钠与水的反应生成氢氧化钠和氧气,过氧化钠既是氧化剂又是还原剂,水既不是氧化剂也不做还原剂,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
(3)硝酸铵会发生爆炸,生成氮气、二氧化氮和水蒸气,反应为:4NH4NO3 $\frac{\underline{\;\;△\;\;}}{\;}$ 3N2↑+2NO2↑+8H2O,20g即0.25mol硝酸铵爆炸放出QkJ的热量,所以4mol硝酸铵爆炸放出16QkJ的热量,即4NH4NO3=3N2↑+2NO2↑+8H2O△H=-16QkJ/mol,故答案为:4NH4NO3=3N2↑+2NO2↑+8H2O△H=-16QkJ/mol;
(4)酸性高锰酸钾溶液具有强的氧化性,可以氧化过氧化氢,即2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O,故答案为:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O;
(5)用双氧水处理氰化钠,产生一种有刺激性气味的气体为氨气,根据原子守恒一种酸式盐为碳酸氢钠,所以反应为:NaCN+H2O2+H2O═NaHCO3+NH3↑,离子反应为:CN-+H2O2+H2O═HCO3-+NH3↑,需要这种双氧水的体积是V,则$\frac{49}{700×1{0}^{6}}=\frac{34}{1.2V×17%}$,解得V=2.38×106,即最少需要这种双氧水2.38×106L,
故答案为:CN-+H2O2+H2O═HCO3-+NH3↑;2.38×106.
点评 本题考查学生氧化还原反应的基本概念、计算以及离子方程式的书写和热化学方程式书写的有关知识,属于综合知识的考查,难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 LCH3CH2OH中含有分子的数目为0.5NA | |
| B. | 58.5gNaCl晶体中含有NA个NaCl分子 | |
| C. | 56g铁粉与一定量氯化铁溶液反应生成0.75molFeCl2,失去的电子数为0.5 NA | |
| D. | 100mL浓度均为0.2mol/L的MgCl2和AlCl3混合溶液中阴离子的数目为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、Br-、S2- | B. | Br-、Cl-、S2- | C. | S2-、Br-、Cl- | D. | Br-、S2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国科学家发明的一种可控锂水电池,可作为鱼雷和潜艇的储备电源.其工作原理如图所示.下列有关说法不正确的是( )
我国科学家发明的一种可控锂水电池,可作为鱼雷和潜艇的储备电源.其工作原理如图所示.下列有关说法不正确的是( )| A. | 电池工作时,电子的流向:锂电极→导线→碳电极 | |
| B. | 水既是氧化剂又是溶剂,有机电解质可用水溶液代替 | |
| C. | 电池总反应为2Li+2H2O=2LiOH+H2 | |
| D. | 该装置不仅可提供电能,还可得到清洁燃料氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1:制备并观察氢氧化亚铁 | B. | 图2:证明过氧化钠与水反应放热 | ||
| C. | 图3:收集二氧化氮气体 | D. | 图4:制备氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
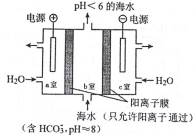 利用如图所示装置从海水中提取CO2,也有利于减少温室气体含量.
利用如图所示装置从海水中提取CO2,也有利于减少温室气体含量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③②①⑤④ | B. | ①②③④⑤ | C. | ②③①④⑤ | D. | ③⑤②①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com