
【题目】下列说法错误的是
A.地球上的非金属元素共有22种
B.宇宙大爆炸产生了氢、氦、锂元素
C.思辨性推测就是科学假设
D.地球上的元素绝大多数是金属元素
科目:高中化学 来源: 题型:
【题目】下图A、B是等体积容器,K是开关,活塞可以左右移动。在一定温度下,关闭K,向A中通入一定量的NO2。发生:2NO2(g)![]() N2O4(g);△H<0。则以下说法不正确的是
N2O4(g);△H<0。则以下说法不正确的是
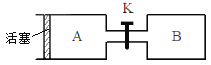
A. 保持活塞位置不变,打开K,体系中气体颜色先变浅、然后略加深
B. 打开K一会,再关闭它,向右推动活塞,最后A容器的气体颜色比B的浅
C. 保持活塞位置不变,打开K一会,再关闭它,把A容器加热,A中气体颜色比B中深
D. 打开K一会,再关闭它,向B中通入氩气,B中气体颜色不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】劣质洗发水中含有超标致癌物二噁烷![]() 。关于该化合物的说法正确的是
。关于该化合物的说法正确的是
A. 与 1,4-丁二醇(CH2OHCH2CH2CH2OH)互为同分异构体
B. l mol 二噁烷完全燃烧消耗 5molO2
C. 分子中所有原子均处于同一平面
D. 一氯代物有 4 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2 L的密闭容器内加入0.2 mol N2和0.6 mol H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
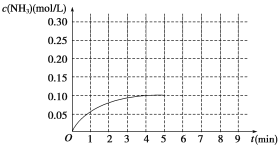
(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为__________。
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为_____________。
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积_____(选填“大于”、“等于”、“小于”)二分之一倍的原体积,化学平衡常数________(选填“增大”、“减小”或“不变”)。
(4)在第5分钟末将容器的体积缩小一半,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在图中画出第5分钟末到达新平衡时NH3浓度的变化曲线_____。
(5)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关二氧化硅的叙述正确的是( )
A.二氧化硅不与任何酸反应
B.二氧化硅能与水反应生成硅酸
C.二氧化硅是酸性氧化物,能与烧碱溶液反应
D.二氧化硅是两性氧化物,能与碱和氢氟酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若N60是与C60相似的另一种“分子足球”,下列说法正确的是
A. N60分子中只含有共价键B. N60和14N都是氮的同位素
C. N60是一种新型化合物D. N60与N2互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应:2A(g)+3B(g)![]() xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法正确的是( )
xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法正确的是( )
A. 2min末时A和B的浓度之比为5:3
B. x=1
C. 2min末时B的浓度为1.5mol/L
D. 2min末时A的消耗浓度为0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+2B(g)![]() 2C(g) ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”“减小”或“不变”)填入空格。
2C(g) ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”“减小”或“不变”)填入空格。
(1)升高温度,B的转化率________,v(正)________,v(逆)________。
(2)加正催化剂,A的物质的量____________,v(正)________,v(逆)________。
(3)保持温度和压强不变,加入稀有气体,则C的物质的量________,A的转化率________。
(4)保持温度和体积不变,加入稀有气体,A的转化率________。
(5)若温度和体积不变,反应从开始到平衡,容器内气体的密度________,压强________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g)![]() CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
(1)反应的平衡常数表达式K=_____________;根据下图,升高温度,K值将__________(填“增大”、“减小”或“不变”)。

(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是______(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是______ (填字母)。
a.v生成(CH3OH)= v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是(填字母)______________。
a.c(H2)减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加 d.重新平衡时c(H2)/ c(CH3OH)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com