
【题目】镍配合物在传感器、磁记录材料、储氢材料、电极催化剂和化学键研究等方面有着广泛的应用。以纯镍片为原料制备一种镍配合物[Ni(NH3)xCly]Clz·nH2O的主要流程如下:
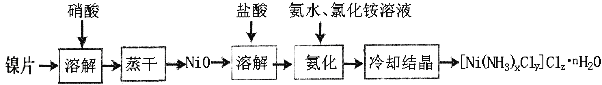
(1)工业上镍氢电池总反应式为:LaNi5H6 + NiOOH ![]() LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:_______________________
LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:_______________________
(2)常温下,镍投入60%的浓硝酸无明显现象,流程中需控制反应温度50-60oC,控温原因可能是_______,写出离子反应方程式:____________________________。
(3)冷却结晶后洗涤、过滤、干燥得到[Ni(NH3)xCly]Clz·nH2O,其中洗涤的正确操作是___________________________________________________________________。
(4)氨化过程中应控制溶液pH范围8~9,其原因是_____________________________。上述流程中,有关说法正确的是___________
A.氨化操作为在过量氨水和氯化铵缓冲溶液中,缓慢滴入酸化的NiCl2溶液,并不断搅拌
B.此缓冲溶液中微粒浓度大小顺序为:c(Cl—)> c(NH3·H2O) >c(NH4+) > c(OH—)> c(H+)
C.冷却结晶后的母液加适量氨水调节pH后可以循环利用
D.可以用热的浓硫酸和浓硝酸混合溶液代替浓硝酸溶解镍片
(5)为测定化合物[Ni(NH3)xCly]Clz·nH2O的组成,进行如下实验:
实验一:称取样品0.6460 g,加入过量的浓NaOH溶液,煮沸,冷却,蒸出的氨用40.00 mL 0.5000 mol·L-1的盐酸完全吸收,并用蒸馏水定容至100 mL,得溶液B。取B溶液20.00 mL,加入指示剂少量,用0.1000 mol·L-1NaOH滴定,消耗NaOH溶液20.00 mL。
实验二:另取该样品0.6460 g,溶于水,以0.1000 mol·L-1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00 mL。相应反应化学方程式为: [Ni(NH3)xCly]Clz+zAgNO3=[Ni (NH3)xCly] (NO3)z+zAgCl↓ 测得该镍配合物的化学式为______________。
【答案】LaNi5H6 —6e—+6OH—==LaNi5 +6H2O 温度高于60oC浓硝酸易分解易挥发;温度低于50oC镍钝化阻止反应继续进行,且反应速率太慢 Ni + 4H+ + 2NO3— ![]() Ni2+ + 2NO2↑+ 2H2O 沿玻璃棒向过滤器中注入少量蒸馏水,使水刚好浸没沉淀,让水自然流下,重复2~3次 防止生成Ni(OH)2沉淀,使产品不纯 AC [Ni(NH3)5Cl]Cl·6H2O
Ni2+ + 2NO2↑+ 2H2O 沿玻璃棒向过滤器中注入少量蒸馏水,使水刚好浸没沉淀,让水自然流下,重复2~3次 防止生成Ni(OH)2沉淀,使产品不纯 AC [Ni(NH3)5Cl]Cl·6H2O
【解析】
(1)根据总方程式可知负极应为LaNi5H6被氧化生成LaNi5;
(2)根据硝酸的热不稳定性,结合题目中的“常温下,镍投入60%的浓硝酸无明显现象”信息解答;
(3)洗涤的基本操作;
(4)如碱性太强,易生成Ni(OH)2沉淀,
A.在过量氨水和氯化铵缓冲溶液中,缓慢滴入酸化的NiCl2溶液,并不断搅拌,可充分反应生成镍配合物;
B.氨水和氯化铵缓冲溶液中c(NH4+)>c(Cl-);
C.冷却结晶后的母液主要为氯化铵;
D.用热的浓硫酸和浓硝酸混合溶液代替浓硝酸,易混入硫酸镍杂质;
(5)结合反应的方程式,从质量守恒的角度计算.
(1)由反应总方程式可知:负极应为LaNi5H6被氧化生成LaNi5,故电极反应式为LaNi5H6-6e-+6OH-═LaNi5+6H2O;
(2)硝酸不稳定,温度较高时易分解,应控制在60°C以下,题中常温下,镍投入60%的浓硝酸无明显现象,说明温度低于50°C镍钝化阻止反应继续进行,且反应速率太慢,反应的离子方程式为:Ni+4H++2NO3-![]() Ni2+ + 2NO2↑+ 2H2O;
Ni2+ + 2NO2↑+ 2H2O;
(3)沿玻璃棒向过滤器中注入少量蒸馏水,使水刚好浸没沉淀,让水自然流下,重复2~3次;
(4)如碱性太强,易生成Ni(OH)2沉淀;
A.在过量氨水和氯化铵缓冲溶液中,缓慢滴入酸化的NiCl2溶液,并不断搅拌,可充分反应生成镍配合物,故A正确;
B.氨水和氯化铵缓冲溶液中c(NH4+)>c(Cl-),故B错误;
C.冷却结晶后的母液主要为氯化铵,可加适量氨水调节pH后可以循环利用,故C正确;
D.用热的浓硫酸和浓硝酸混合溶液代替浓硝酸,易混入硫酸镍杂质,故D错误;
故:防止生成Ni(OH)2沉淀,使产品不纯;AC;
(5)发生反应为NaOH+HCl=NaCl+H2O;NH3+HCl=NH4Cl,n(HCl)=0.04L×0.5mol·L-1=0.02mol,用蒸馏水定容至100mL,得溶液B.取B溶液20.00mL,加入指示剂少量,用0.1000mol·L-1NaOH滴定,消耗NaOH溶液20.00mL,则20mL中n(NaOH)=0.1mol·L-1×0.02L=0.002mol,即20mL中含有n(HCl)=0.002mol,100mL中含有n(HCl)=0.01mol,所以n(NH3)=0.02mol-0.01mol=0.01mol,
另取该样品0.6460g,溶于水,以0.1000mol·L-1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00mL,n(AgNO3)=0.1mol·L-1×0.02L=0.002mol,根据反应 [Ni(NH3)xCly]Clz+zAgNO3=[Ni (NH3)xCly] (NO3)z+zAgCl↓ 可知,n(AgCl)=0.002mol,则x/z=0.01mol/0.002mol=5,所以x=5,z=1,又Ni的配位数为6,则y=1,则M([Ni(NH3)xCly]Clz·nH2O)=0.6460g/0.002mol=323g·mol-1,则59+17×5+2×35.5+18n=323,n=6,则该配合物的化学式为[Ni(NH3)5Cl]Cl·6H2O。


科目:高中化学 来源: 题型:
【题目】对于NaCl的下列叙述正确的是( )
A. 表示一个氯化钠分子 B. 在氯化钠中存在钠原子和氯原子
C. Na+与Cl-的结构示意图相同 D. Na+与Cl-之间存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应能设计成原电池的是( )
A. Cu与Cl2的燃烧反应 B. Ba(OH)2·8H2O与NH4Cl反应
C. 灼热的炭与CO2反应 D. 氢氧化钠溶液与稀盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:![]() 已知
已知![]()
容器 | 甲 | 乙 | 丙 |
反应物的投入量 |
|
|
|
|
|
|
|
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
体系的压强 |
|
|
|
反应物的转化率 |
|
|
|
下列说法正确的是![]()
![]()
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
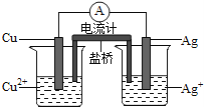
【题目】银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照相器材等领域亦有广泛应用![]() 回答下列问题:
回答下列问题:
(1)久存的银制品表面会变黑,失去银白色光泽,原因是 ____________________ .
(2)已知![]() ,若向
,若向![]() 的
的![]() 溶液中加入
溶液中加入![]() 的盐酸,混合后溶液中
的盐酸,混合后溶液中![]() 的浓度为 ______________
的浓度为 ______________ ![]() ,pH为 _______________ .
,pH为 _______________ .
(3)![]() 光照易分解,生成Ag和红棕色气体等物质,其光照分解反应的化学方程式为 _______________________________________ .
光照易分解,生成Ag和红棕色气体等物质,其光照分解反应的化学方程式为 _______________________________________ .
(4)如图所示原电池正极的反应式为________________________________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙酮(CH3COCH3)在某溶剂里,在催化剂作用下发生反应:2CH3COCH3(aq) ![]() CH3COCH2COH(CH3)2(aq);取相同浓度的CH3COCH3,分别在40℃和60℃时,测得其转化率
CH3COCH2COH(CH3)2(aq);取相同浓度的CH3COCH3,分别在40℃和60℃时,测得其转化率![]() 随时间变化的关系曲线(
随时间变化的关系曲线(![]() )如图所示。
)如图所示。
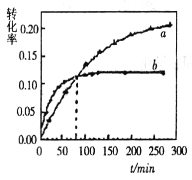
下列说法正确的是
A.b代表40℃时CH3COCH3的a—t曲线
B.升高温度可缩短该反应达平衡的时间并能提高平衡转化率
C.增大压强可缩短该反应达平衡的时间并能提高平衡转化率
D.上述反应的逆反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铁溶液与碘化钾溶液反应:Fe3++2I-===Fe2++I2
B. 硫酸溶液与氢氧化钡溶液反应:Ba2++SO![]() ===BaSO4↓
===BaSO4↓
C. 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑
D. 氯化铝溶液与过量氨水反应:Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
①晶体中分子间作用力越大,分子越稳定 ②原子晶体中共价键越强,熔点越高 ③干冰是CO2分子通过氢键和分子间作用力有规则排列成的分子晶体 ④在Na2O和Na2O2晶体中,阴、阳离子数之比相等 ⑤正四面体构型的分子,键角都是109°28′,其晶体类型可能是原子晶体或分子晶体 ⑥分子晶体中都含有化学键 ⑦含4.8 g碳元素的金刚石晶体中的共价键的物质的量为0.8 mol
A. ①②③④⑤ B. ②④⑦ C. ⑤⑥⑦ D. ③④⑤⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com