
| A.CaO | B.NaOH | C.CuCO3 | D.Cu2(OH)2CO3 E.Fe2(SO4)3 |
 =10-33,解得c(OH-)=10-11(mol·L-1),故pH=3.0。③根据Fe3++3H2O??Fe(OH)3+3H+,可加入 CuCO3、Cu2(OH)2CO3等促使平衡正向移动,从而生成氢氧化铁沉淀而除去Fe3+,并且不引入新杂质。
=10-33,解得c(OH-)=10-11(mol·L-1),故pH=3.0。③根据Fe3++3H2O??Fe(OH)3+3H+,可加入 CuCO3、Cu2(OH)2CO3等促使平衡正向移动,从而生成氢氧化铁沉淀而除去Fe3+,并且不引入新杂质。

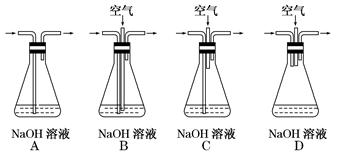
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2 (g)+ H2 (g) △H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有 ,已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中,c(H2O)﹕c(CO)不低于 ,
CO2 (g)+ H2 (g) △H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有 ,已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中,c(H2O)﹕c(CO)不低于 , CO2 (g)+ H2 (g),已知c(CO)与反应时间t变化曲线Ⅰ
CO2 (g)+ H2 (g),已知c(CO)与反应时间t变化曲线Ⅰ

 =4,CO2的转化率随时间的变化关系如右图所示.
=4,CO2的转化率随时间的变化关系如右图所示.查看答案和解析>>
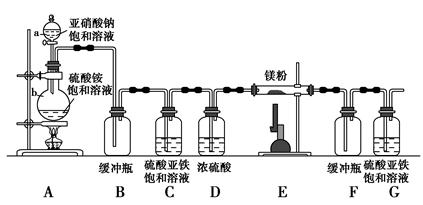
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| 表达要求 | 只含b的代数式 | 只含c的代数式 |
| a的取值范围 | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.银的质量为10.8g |
| B.NO与NO2的体积比之比(相同条件下)为2:1 |
| C.原硝酸的物质的量浓度 (0.1mol+4b×10-3mol)/0.5L |
| D.沉淀中Cu(OH)2的物质的量为0.05mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com