
����Ŀ��ij��ѧС�����û������Ʊ�����ϩ���������������£���Ӧԭ����  ��Ӧ���������������ʣ�
��Ӧ���������������ʣ�
�ܶȣ�g/cm3�� | �۵㣨�棩 | �е㣨�棩 | �ܽ��� | |
������ | 0.96 | 25 | 161 | ������ˮ |
����ϩ | 0.81 | ��103 | 83 | ������ˮ |
��1��ʵ������п��ܷ������л�����Ӧ�ķ���ʽΪ ��
��2�������������ϣ�װ�ã�A��B��C��������������ɱ����Ʊ�ʵ�飮 
��3���Ʊ��ֲ�Ʒ ��5mL�����Թ�A�У��ټ���10m �� ҡ�Ⱥ�������Ƭ��������������Ӧ��ȫ��
��4���ֲ�Ʒ�ᴿ �ٻ���ϩ�ֲ�Ʒ�к��л������������������ʵȣ��ֲ�Ʒ�����ξ���ˮϴ����̼������Һϴ���Լ��ڶ���ˮϴ���ڴ˹����м���̼������Һ��Ŀ��������Һʱ������ϩӦ�ӷ�Һ©��������ϡ����¡�����ȡ����
����ˮϴ��Ļ���ϩ�м�����������ˮ�Ȼ��ƣ��ٽ���������ͼD��ʾװ�õ������������ƣ��У����������ռ���Ʒʱ���¶ȼ���ʾ���¶�ӦΪ ��
���𰸡�
��1��![]()
��2��C
��3����������Ũ����
��4����ȥ����ϩ�������������ʣ��ϣ�������ƿ��85��
���������⣺��1����Ũ���������������������£����ܷ���ȡ����Ӧ�����ѣ����Ը������£�����������ȡ����Ӧ�����ѣ� ��Ӧ����ʽΪ![]() ��
��
���Դ��ǣ�![]() ����2����ʵ����Ҫ���¶���85�棬������Ҫˮԡ���ȣ��¶ȼ�Ӧ�ò���ˮԡ�¶ȣ�Ȼ����������ķ�����ȡ�������ѡȡ��װ��Ӧ����C����ѡC����3����Ӧװ����Ӧ���ȼ��ܶ�С�����ʺ���ܶȴ�����ʣ��������ܶ�С��Ũ���ᣬ����Ӧ���ȼӻ��������Ũ���ᣬ�ҷ�ֹҺ�彦����������ȫ�¹ʣ����Դ��ǣ���������Ũ�����4����̼���ƺ����ᷴӦ���ɿ����Ե������ƣ��Ӷ���ȥ�����Һʱ���ϲ�Һ����Ͽڵ������²�Һ����¿ڵ���������ϩ�ܶ�С��ˮ�Ҳ�����ˮ�����Ժ�ˮ������ϲ㣬���Һʱ����ϩ�ӷ�Һ©���Ͽڵ��������Դ��ǣ���ȥ����ϩ�������������ʣ��ϣ�
����2����ʵ����Ҫ���¶���85�棬������Ҫˮԡ���ȣ��¶ȼ�Ӧ�ò���ˮԡ�¶ȣ�Ȼ����������ķ�����ȡ�������ѡȡ��װ��Ӧ����C����ѡC����3����Ӧװ����Ӧ���ȼ��ܶ�С�����ʺ���ܶȴ�����ʣ��������ܶ�С��Ũ���ᣬ����Ӧ���ȼӻ��������Ũ���ᣬ�ҷ�ֹҺ�彦����������ȫ�¹ʣ����Դ��ǣ���������Ũ�����4����̼���ƺ����ᷴӦ���ɿ����Ե������ƣ��Ӷ���ȥ�����Һʱ���ϲ�Һ����Ͽڵ������²�Һ����¿ڵ���������ϩ�ܶ�С��ˮ�Ҳ�����ˮ�����Ժ�ˮ������ϲ㣬���Һʱ����ϩ�ӷ�Һ©���Ͽڵ��������Դ��ǣ���ȥ����ϩ�������������ʣ��ϣ�
�ڽ�������ʱʢ��ҩƷ��������������ƿ�����ݷ�Ӧ�¶�ֵ���ռ���Ʒ��Ҫ���¶���85�棬���Դ��ǣ�������ƿ��85�森


 ������ʱͬ����ϰ��ϵ�д�
������ʱͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���£�N2H4���ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�أ�NO2�Ķ�����N2O4���ǻ���г������������Իش��������� 
��1����ȼ�ϵ��ԭ����ͼ��ʾ��N2H4ͨ���һ��ӦΪ��ص������������������
��2���������N2O4��������������ȼ�ϣ���֪�� N2��g��+2O2��g���T2NO2��g����H=��67.7kJmol��1
N2H4��g��+O2��g���TN2��g��+2H2O��g����H=��534.0kJmol��1
2NO2��g��N2O4��g����H=��52.7kJmol��1
��д����̬������̬������������ȼ�����ɵ�������̬ˮ���Ȼ�ѧ����ʽ ��
��3�������Ĺ�ҵ�������ð��ʹ�������Ϊԭ�ϻ�ã�Ҳ��������[CO��NH2��2]�ʹ������Ʃ�����������Һ��Ӧ��ã���д�����ط���Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�ѧ��Ӧ�У�ֻ�м�����������ƽ�������ߵö�ķ�Ӧ����ӷ�����ײʱ�ſ��ܷ�����ѧ��Ӧ����Щ���ӳ�Ϊ����ӣ�ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ������л�ܣ��䵥λͨ����kJ/mol��ʾ��������۲���ͼ��Ȼ��ش����⣺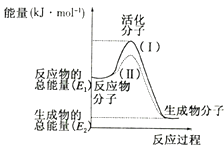
��1��ͼ����ʾ��Ӧ��������ȡ����ȡ�����Ӧ���÷�Ӧ�ġ�H=���ú�E1��E2�Ĵ���ʽ��ʾ����
��2������4����Ӧ�з���ʾ��ͼ�����ķ�Ӧ���� ������ţ���
A.ˮ������̿��Ӧ
B.��ˮϡ������������Һ
C.������Fe2O3��Ӧ
D.���ȵ�̼��CO2��Ӧ
��3����֪�Ȼ�ѧ����ʽ��H2��g��+ ![]() O2 ��g��=H2O��g����H=��241.8kJ/mol���÷�Ӧ�Ļ��Ϊ167.2kJ/mo1�������淴Ӧ�Ļ��Ϊ ��
O2 ��g��=H2O��g����H=��241.8kJ/mol���÷�Ӧ�Ļ��Ϊ167.2kJ/mo1�������淴Ӧ�Ļ��Ϊ ��
��4���Լ���Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ������֪��
CH4 ��g��+H2O��g��=CO��g��+3H2��g����H=+206.2kJ/mol
CH4��g��+CO2��g��=2CO��g��+2H2 ��g����H=+247.4kJ/mol
CH4��g����H2O��g����Ӧ����CO2��g����H2��g�����Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ�����з������ʱ仯��ͬʱ���������������ı仯�����������ı仯������������ʽ���ֳ�����������Ӧ�ȣ����ڷ�Ӧ�������ͬ����Ӧ�ȿɷ�Ϊ�����֣����ȼ���Ⱥ��кͷ�Ӧ��Ӧ�ȵȣ�
��1�����С�H��ʾ���ʱ�ȼ���ȵ��� ����ʾ�кͷ�Ӧ��Ӧ�ȵ��� �������H1��������H2��������H3���ȣ�
A��2H2��g��+O2��g���T2H2O��l����H1B��C��s��+![]() O2��g���TCO��g����H2=��Q1kJmol��1
O2��g���TCO��g����H2=��Q1kJmol��1
C��CH4��g��+2O2��g���TCO2��g��+2H2O��g����H3D��C��s��+O2��g���TCO2��g����H4=��Q2kJmol��1
E��NaOH��aq��+HCl��aq���TNaCl��aq��+H2O��l����H5
��2��2.00g C2H2������ȫȼ������Һ̬ˮ��CO2���壬�ų�99.6kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ���� ��
��3�������⣨1����B��D�ж�1molCO��g����ȫȼ�յġ�H= ��
��4����ӦE�ġ�H6��������ͼ��ʾ��װ�ý��в�����ʵ����ֱ�Ӳⶨ�������� ����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ�� �����ձ����粻��Ӳֽ�壬��õ��кͷ�Ӧ�ķ�Ӧ�ȵ���ֵ ���ƫ��ƫС������Ӱ�족����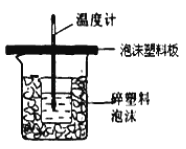
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ˮ��Һ���Ե��磬���DZ������ǵ���ʵ�Ϊ( )
A. CO2 B. HCl C. ���� D. BaCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ10L���ܱ������У�1mol X��1mol Y���з�Ӧ��2X��g��+Y��g��Z��g������60s�ﵽƽ�⣬����0.3mol Z������˵����ȷ���ǣ� ��
A.������ѹǿ��������Y��ת���ʼ�С
B.�����������Ϊ5 L��Z��ƽ��Ũ�ȱ�Ϊԭ����2��
C.YŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.0005 mol/��Ls ��
D.�������¶ȣ�X���������������÷�Ӧ�ġ�H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�����ˡ�84����Һ��˵���е��䷽������NaClO��������480mL��NaClO25%���ܶ�Ϊ1.19g/cm3������Һ������˵����ȷ����( )
A.���ƹ���ֻ��Ҫ���������������
B.����ƿ������ˮϴ��������ɲ���������Һ������
C.����ʱ��������ƿ�Ŀ̶��ߣ������������Һ���ʵ���Ũ��ƫ��
D.����������ƽ������NaClO���������Ϊ148.8g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̲�ʵ�������ո��л�ѧʵ��Ļ����������⻯ѧ��ѧ��ʵ��ԭ����ʵ�鷽����ʵ��˼·�����ѧ��ʵ�������Ļ���;��:
(1)ʵ��1:ȡһ������ƣ��ڲ���Ƭ������ֽ���ɱ����ú�ͺ���С����ȥһ�˵���Ƥ���۲��Ƶ���ɫ�����ʵ���л����õ���һ��������_________��
(2)ʵ��2:��һ��ʢ��ˮ��С�ձ�����뼸�η�̪��Һ��Ȼ���һС����Ͷ��С�ձ����ѷ�Ӧ���������Ӧ��������ո�������--�Ƶ��ܶȱ�ˮС��������--��Ӧ��������������������������______________��
(3)ʵ��3��������ǯ��סһС����ɰֽ��ϸ��ĥ���������ھƾ����ϼ������ۻ��������ۻ������������䡣���й�������ʵ������Ľ�����ȷ����_________
A.�����¶�̫�Ͳ���ʹ��ȼ�� B.���ڿ������ܺܿ��γ�����Ĥ
C.���������۵�ȳ����۵�� D.��ĥɰֽ���ܳ�ȥ���������Ĥ
(4)ʵ��4:������ˮ����ʢ��Na2O2������Թ��У������ô����ǵ�ľ�������Թܿڣ�����
���ɵ������壬��Ӧ�����Һ�м����̪��Һ�����Կ���__________��
(5)ʵ��5:�ڲ������з��뻹ԭ���ۺ�ʯ���Ļ������ȣ���ͨ��ˮ����,��������ԭ��Ӧ����������__________���÷�Ӧÿ����1mol����ת�Ƶ��ӵ����ʵ���Ϊ_________��
(6)ʵ��6:���Թ���ע���������Ʊ���FeSO4��Һ���ý�ͷ�ι���ȡNaOH��Һ�����ιܼ�˲����Թ�����Һ�ײ�����������NaOH��Һ�����Կ�����ʼʱ����һ�ְ�ɫ����״��������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ������������Ҳ�仯��ԭ����(�û�ѧ����ʽ��ʾ):______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӻ�ѧ��ѧ�Ĵ�������������Ͻ�����ѧ�������ǣ� ��
A.��ʶ���Ӻ��������B.��Ȼ��ѧ
C.�о�����ʮ�ֹ㷺D.�����������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com