
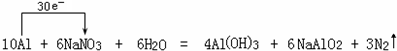 ;
;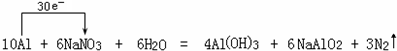 ;
;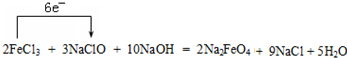 ;
;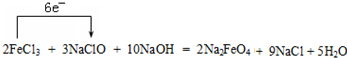 .
.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
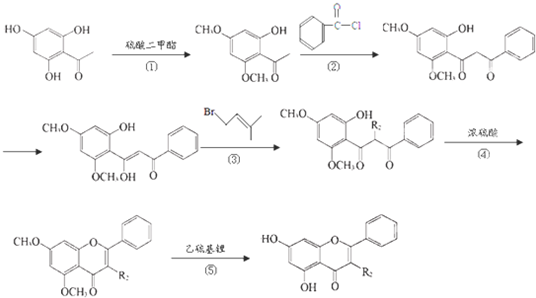
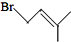 的同分异构体有
的同分异构体有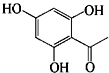 说法正确的是
说法正确的是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
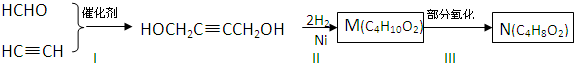
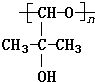
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液态硫酸不导电,硫酸是非电解质 |
| B、NaHSO4在熔融状态下电离产生Na+和HSO4-两种离子 |
| C、溶于水后能导电的化合物一定是电解质 |
| D、电解质在电流的作用下电离产生离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、CuO作还原剂 |
| B、CO作氧化剂 |
| C、铜元素的化合价降低 |
| D、碳元素的化合价降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
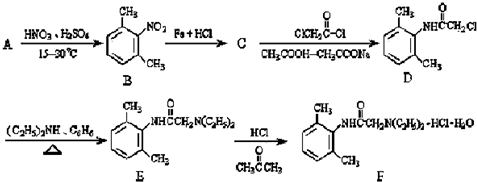
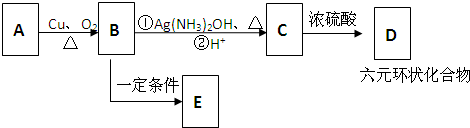
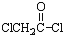 与足量的NaOH溶液共热充分反应的化学方程式:
与足量的NaOH溶液共热充分反应的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
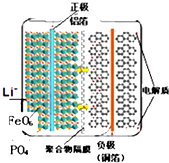 磷酸铁锂电池的内部结构如图所示,左边是磷酸铁锂电池材料为电池的正极,有铝箔与电池正极连接,中间是聚合物的隔膜,它把 正极与负极隔开,但锂离子Li+可以通过而电子电子不能通过,右边是由碳(石墨)组成的电池负极,由铜箔与电池的负极连接.电池的上下端之间是电池的电解质,电池由金属外壳密闭封装.电池的总反应为:Li1-xFePO4+LixC6
磷酸铁锂电池的内部结构如图所示,左边是磷酸铁锂电池材料为电池的正极,有铝箔与电池正极连接,中间是聚合物的隔膜,它把 正极与负极隔开,但锂离子Li+可以通过而电子电子不能通过,右边是由碳(石墨)组成的电池负极,由铜箔与电池的负极连接.电池的上下端之间是电池的电解质,电池由金属外壳密闭封装.电池的总反应为:Li1-xFePO4+LixC6| 放电 |
| 充电 |
| A、磷酸铁锂电池放电时,锂离子从负极中脱出来,经过电解液,穿过隔膜回到正极材料中 |
| B、放电时负极反应:C6Li-xe-═6C+xLi+ |
| C、充电时阳极反应:LiFePO4-xe-═Li1-xFePO4+xLi+ |
| D、若用该电池电解精炼粗铜,阳极质量减少12.8g时,则电池中通过聚合物隔膜的Li+数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 某溶液中加入盐酸酸化的BaCl2溶液 | 白色沉淀 | 溶液中一定含有SO42- |
| B | 用激光笔照射鸡蛋白溶液 | 有丁达尔效应 | 鸡蛋白溶液属于胶体 |
| C | 某气体通入酸性KMnO4溶液中 | 紫色褪去 | 该气体一定是SO2 |
| D | 用铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 溶液中无K+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com