
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
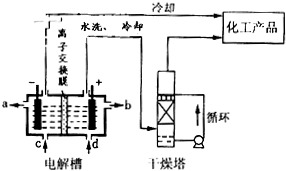
| ||
| ||
| △ |
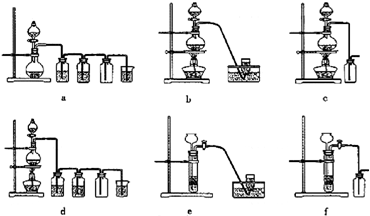
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省泰安市高三第一轮复习质量检测化学试卷(解析版) 题型:填空题
新型材料纳米级Fe粉具有超强的磁性,能用作高密度磁记录的介质以及高效? 催化剂等。
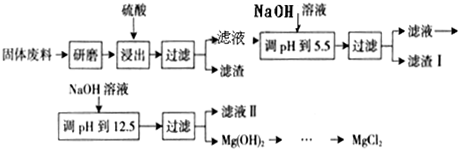
I.实验室采用气相还原法制备纳米级Fe,其流程如下:

(1) 固体加热脱水通常要通入????????????????????????????????????? 。
固体加热脱水通常要通入????????????????????????????????????? 。
(2)生成纳米级Fe的化学方程式为????????????????????????????????????????????? 。
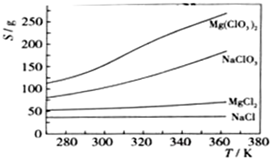
Ⅱ.在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同:温度低于570℃时生成FeO,高于570℃时生成 。甲同学用下图所示装置进行纳米级Fe粉与水蒸气的反应并验证固体产物。
。甲同学用下图所示装置进行纳米级Fe粉与水蒸气的反应并验证固体产物。

(3)B中收集到的气体是?????????????? (填名称),C装置的作用是????????? 。
(4)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:

乙同学认为该条件下反应的固体产物为FeO。丙同学认为该结论不正确,他的理由是????????????????? (用离子方程式表示)。
(5)丁同学称取5.60gFe粉,反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g。然后将冷却后的固体物质与足量FeCl3溶液充分反应,消耗0.08molFeCl3。丁同学实验的固体产物为??????????????????????? 。
查看答案和解析>>
科目:高中化学 来源:湖南省同步题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com