
 ,故答案为:Na;
,故答案为:Na; ;
;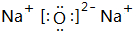 、
、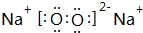 ,故答案为:
,故答案为: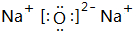 、
、 ;
;

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
| c(Cl-) |
| c(ClO-) |
A、若某温度下,反应后
| ||||||
B、参加反应的氯气的物质的量等于
| ||||||
C、改变温度,反应中转移电子的物质的量ne的范围:
| ||||||
D、改变温度,产物中KClO3的最大理论产量为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
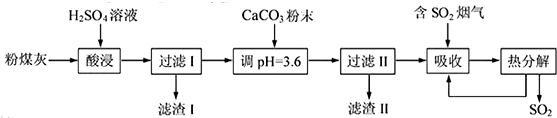
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 相关 信息 |
其单质是一种本身有毒又可用来消毒的有色气体 | 其单质既有金属性,又有一定的非金属性(但属于金属) | 其最外层电子数是电子层数的2倍,且能形成熔点高硬度大的稳定单质 | 其简单离子核外电子层结构与Ar原子电子层结构相同,单质常出现在火山喷口附近或地壳的岩层里 |
查看答案和解析>>
科目:高中化学 来源: 题型:
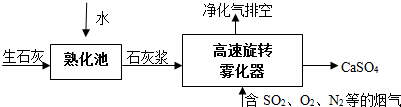
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
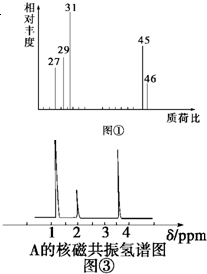 为测定某有机化合物A的结构,进行如下实验:
为测定某有机化合物A的结构,进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
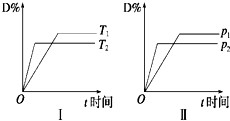 对于可逆反应mA(g)+nB(s)?pC(g)+qD(g),反应过程中,其他条件不变时,产物D的物质的量分数D%与温度T或压强p的关系如图,下列说法正确的是( )
对于可逆反应mA(g)+nB(s)?pC(g)+qD(g),反应过程中,其他条件不变时,产物D的物质的量分数D%与温度T或压强p的关系如图,下列说法正确的是( )| A、化学方程式中化学计量数:m>p+q |
| B、降温可使化学平衡向正反应方向移动 |
| C、使用合适的催化剂可使D%有所增加 |
| D、B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com