
| A. | 将水加热,pH减小 | |
| B. | 恒温下,向水中加入少量固体KOH,Kw不变 | |
| C. | 向水中加入金属钠,c(H+)减小 | |
| D. | 向水中通入氯化氢气体,平衡正向移动 |
分析 A、水的电离吸热;
B、水的离子积Kw只受温度的影响;
C、向水中加入金属钠,生成氢氧化钠;
D、向水中通入HCl气体,溶液显酸性.
解答 解:A、水的电离吸热,故将水加热,水的电离平衡右移,溶液中的氢离子浓度增大,pH减小,故A正确;
B、水的离子积Kw只受温度的影响,故加入KOH,但只要温度不变,Kw不变,故B正确;
C、向水中加入金属钠,生成氢氧化钠,溶液中的氢氧根浓度增大,则氢离子浓度减小,故C正确;
D、向水中通入HCl气体,溶液中氢离子浓度增大,则对水的电离有抑制作用,平衡左移,故D错误.
故选D.
点评 本题考查了影响水的电离平衡的因素和影响Kw的因素,难度不大,应注意的是升高温度,水的电离被促进,但纯水仍然显中性.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
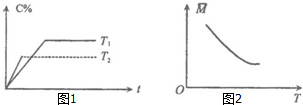
| A. | m+n>p,△H>0 | B. | m+n>p,△H<0 | C. | m+n<p,△H>0 | D. | m+n<p,△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500mL 1mol•L-1的KNO3溶液 | B. | 500mL 1mol•L-1的Ba(NO3)2溶液 | ||
| C. | 1000mL 0.5mol•L-1的Mg(NO3)2溶液 | D. | 1000mL 0.5mol•L-1的Fe(NO3)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ | Ag+ | Ca2+ | Ba2+ |
| 阴离子 | NO${\;}_{3}^{-}$ | CO${\;}_{3}^{2-}$ | SiO${\;}_{3}^{2-}$ | SO${\;}_{4}^{2-}$ |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色胶状沉淀并放出标准状况下0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3与稀硝酸反应生成CO2,CaSO3也能与稀硝酸反应生成SO2 | |
| B. | 铜在Cl2中燃烧生成二价铜,铜也能在硫蒸气中燃烧生成二价铜 | |
| C. | 锌可以与溶液中的银离子发生置换反应,钠也能与溶液中的银离子发生置换反应 | |
| D. | 钠与乙醇反应产生氢气,钾与乙醇也能反应产生氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化分子一定能发生有效碰撞 | |
| B. | 增大反应物浓度,可以提高活化分子百分数 | |
| C. | 升高温度,可以降低活化能,加快反应速率 | |
| D. | 活化能越小,一般分子就越容易成为活化分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
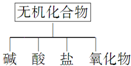 无机化合物可根据其组成和性质进行分类:
无机化合物可根据其组成和性质进行分类:| 物质类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | ①HCl ②H2SO4 | ③NaOH ④Ba(OH)2 | ⑤Na2CO3 ⑥K2CO3 | ⑦CO2 ⑧K2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com