
如图装置中发生反应的离子方程式为:Zn+2H+═Zn2++H2↑,下列说法错误的是()

A. a、b不可能是同种材料的电极
B. 该装置可能是电解池,电解质溶液为稀盐酸
C. 该装置可能是原电池,电解质溶液为稀盐酸
D. 该装置可看作是铜﹣锌原电池,电解质溶液是稀硫酸
考点: 原电池和电解池的工作原理.
专题: 电化学专题.
分析: 根据Zn+2H+═Zn2++H2↑知,锌失电子发生氧化反应,氢离子得电子发生还原反应,该装置可能是原电池也可能是电解池,锌发生的反应可能是原电池负极也可能是电解池阳极上发生的反应,则氢离子发生的反应可能是原电池正极也可能是电解池阳极上发生的反应,如果是原电池,则锌作负极,比锌不活泼的金属或导电的非金属作正极,电解质溶液为酸溶液,如果是电解池,则阳极是锌,电解质溶液是酸或活动性顺序在氢之前的金属盐溶液,据此分析解答.
解答: 解:A.如果该装置是电解池,如锌作阴、阳极,电解质溶液是酸,阳极上锌失电子,阴极上氢离子得电子,符合离子反应方程式,所以两个电极可以相同,故A错误;
B.该装置可能是电解池,电解质溶液是稀盐酸,锌作阳极,电解时,阳极上锌失电子,阴极上氢离子得电子,符合离子反应方程式,故B正确;
C、该装置可能是原电池,电解质溶液为稀盐酸,锌作负极,正极上氢离子得电子,发生的反应符合离子方程式,故C正确;
D、该装置可看作是铜﹣锌原电池,电解质溶液是稀硫酸,负极上锌失电子,正极氢离子得电子,符合离子方程式,故D正确.
故选A.
点评: 本题考查了原电池和电解池原理,同时考查学生的发散思维能力,明确正、负极和阴、阳极上发生反应的类型是解本题的关键,难度不大.


科目:高中化学 来源: 题型:
4A(s)+3B(g)═2C(g)+D(g),经2min后B的浓度减少0.6mol•L﹣1.对此反应速率的表示正确的是()
A. 用A表示的反应速率是0.4mol•L﹣1•min﹣1
B. 分别用B、C、D表示反应速率,其比值是3:2:1
C. 在2min末的反应速率,用B表示是0.3mol•L﹣1•min﹣1
D. 在2min内的反应速率,用C表示是0.3mol•L﹣1•min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
对处于化学平衡的体系,由化学平衡与化学反应速率的关系可知()
A. 化学反应速率变化时,化学平衡一定发生移动
B. 化学平衡发生移动时,化学反应速率一定变化
C. 正反应进行的程度大,正反应速率一定大
D. 改变压强,化学反应速率一定改变,平衡一定移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
A. 生成物的总能量一定低于反应物的总能量
B. 分解反应一定是吸热反应
C. 应用盖斯定律,可计算某些难以直接测量的反应的焓变
D. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,△H1=﹣393.5kJ•mol﹣1,△H2=﹣395.4kJ•mol﹣1,下列说法或表示式正确的是()
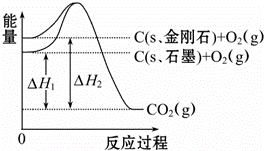
A. C(s、石墨)═C(s、金刚石)△H=+1.9 kJ•mol﹣1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的能量比1 mol金刚石的总能量大
查看答案和解析>>
科目:高中化学 来源: 题型:
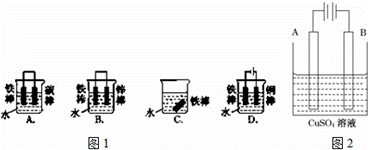
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一.请回答钢铁在腐蚀、防护过程中的有关问题.
(1)图1哪个装置可防止铁棒被腐蚀BD.
(2)在实际生产中,可在铁 件的表面镀铜防止铁被腐蚀.装置示意图如图2. 请回答
件的表面镀铜防止铁被腐蚀.装置示意图如图2. 请回答
①A电极对应的金属是铜(写元素名称),B电极的电极反应式是 .
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
关于热化学方程式:2H2(g)+02(g)=2H20(1),△H=﹣571.6kJ•mol﹣1,下列有关叙述不正确的是()
A. 2mol H2完全燃烧生成液态水时放出571.6 kJ的热
B. 1mol H2完全燃烧生成液态水时放出285.8kJ的热
C. 2个氢分子完全燃烧生成液态水时放出571.6 kJ的热
D. 上述热化学方程式可表示为H2(g)+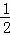 O2(g)=H20(1),△H=﹣285.8 kJ•mol﹣1
O2(g)=H20(1),△H=﹣285.8 kJ•mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为 .
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2 (g)+Cl2 (g)=2HCl (g)△H=﹣185kJ/molE(H﹣H)=436kJ/mol E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+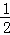 O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
C(s)+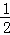 O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJ•mol﹣1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为 .
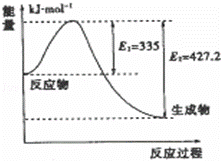
(4)①如图是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为: .
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为 ;若在同体积的容器中充入2mol N2和6mol H2,达平衡后放出的热量为Q2 kJ,则Q2 2Q1(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 要实现Fe2+→Fe3+的转化必须加入氧化剂
B. 失电子难的原子获得电子的能力一定强
C. 得到电子越多的氧化剂,其氧化性就越强
D. 阳离子只有氧化性,阴离子只有还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com