
【题目】由H、C、N、O、S等元素形成多种化合物在生产生活中有着重要应用。
I.化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g)△H1=-36kJ·mol-1
2CH4(g)+H2O(g)=CO(g)+3H2(g)△H2=+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,年生产lmolCO,转移电子的数目为______________________。
(2)甲醇催化脱氢可制得重要的化工产品一甲醛,制备过程中能量的转化关系如图所示。
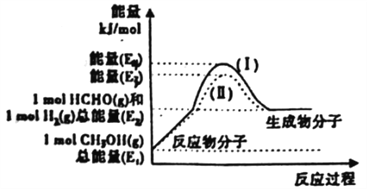
①写出上述反应的热化学方程式________________________________。
②反应热大小比较:过程I________过程II(填“大于”、“小于”或“等于”)。
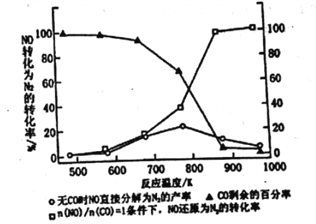
II.(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领城的重要课题。某研究性小组在实验室以Ag-ZSM-5为催化剂,删得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775K,发现NO的分解率降低。其可能的原因为_____________________________________,
在n(NO)/n(CO)=1的条件下,为更好的除去NOx物质,应控制的最佳温度在_______K左右。
(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式_________________________________________;
②若T1<T2
③上述反应T1℃时达到化学平衡后再通入0.1mol NO气体,则达到新化学平衡时NO的转化率为______。
【答案】 6NA CH3OH(g)=HCHO(g)+H2(g) ΔH=+(E2-E1)kJ/mol 等于 NO分解反应是放热反应,升高温度不利于反应进行(只写升高温度不利于反应进行也得满分,其他合理说法也得分) 870(接近即可给分) C(s)+2NO(g)![]() CO2(g)+N2(g) < 80%
CO2(g)+N2(g) < 80%
【解析】为维持热平衡,①×6+②相加可得7CH4(g)+3O2(g)+H2O(g)=7 CO(g)+15H2(g) △H=0,反应中生成7molCO转移电子总数42mol,所以产生lmolCO转移的电子数为6NA;正确答案:6NA。
(2)①根据图示所示,ΔH=生成物总能量-反应物总能量=(E2-E1)kJ/mol,反应的热化学方程式为:CH3OH(g)=HCHO(g)+H2(g) ΔH=+(E2-E1)kJ/mol;正确答案:CH3OH(g)=HCHO(g)+ H2(g) ΔH=+(E2-E1)kJ/mol。
②ΔH为E2和E1的差值,根据图示可知 E2-E1的差值没有发生变化,所以过程I和过程II反应热相等;正确答案:相等。
(3)从图像变化可以看出,当不使用CO时,温度超过775K,发现NO的分解率降低,说明NO分解反应是放热反应,升高温度,平衡左移,不利于反应向右进行;正确答案:NO分解反应是放热反应,升高温度不利于反应进行(只写升高温度不利于反应进行也得满分,其他合理说法也得分)。在n(NO)/n(CO)=1的条件下,为更好的除去NOx物质,要求NO转化率越大越好,根据图像分析,应控制的最佳温度在870K左右;正确答案:870(接近即可给分)。
(4)①根据表中信息:反应物的变化量分别为:n(C)=0.04 mol,n(NO)=0.08 mol, n(E)= n(F) =0.04 mol;即各物质的系数之比为1:2:1:1,根据原子守恒规律可知反应的方程式为:C(s)+2NO(g)![]() CO2(g)+N2(g);正确答案:C(s)+2NO(g)
CO2(g)+N2(g);正确答案:C(s)+2NO(g)![]() CO2(g)+N2(g)。
CO2(g)+N2(g)。
②温度为T1℃,n(NO)=0.08 mol,,温度为T2℃,n(NO)=0.05 mol,,若T1<T2,升高温度,平衡左移,n(NO)减少,该反应正反应为放热反应;正确答案:<。
③T1℃时,容器的体积为5升,发生如下反应
C(s) + 2NO(g)![]() CO2(g)+ N2(g)
CO2(g)+ N2(g)
起始量 3 0.1 0 0
变化量 0.04 0.08 0.04 0.04
平衡量 2.96 0.02 0.04 0.04
反应的平衡常数为K=c(N2) c(CO2)/ c2(NO)=(0.04/5)2/(0.02/5)2=4;上述反应T1℃时达到化学平衡后再通入0.1mol NO气体,设反应生成CO2为xmol, 则:
C(s) + 2NO(g)![]() CO2(g) + N2(g)
CO2(g) + N2(g)
起始量 2.96 0.12 0.04 0.04
变化量 2x x x
平衡量 0.12-2x 0.04+ x 0.04+ x
由于温度不变,平衡常数保持不变;[(0.04+ x)/5]2/[(0.12-2x)/5]2=4,解之x=0.04mol
则达到新化学平衡时NO的转化率为(2×0.04)/0.1×100%=80%;正确答案:80%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A. pH=1的NaHSO4溶液: c(H+)=c(SO![]() )+c(OH-)
)+c(OH-)
B. 含有AgCl和AgI固体的悬浊液: c(Ag+)>c(Cl-)=c(I-)
C. CO2的水溶液:c(H+)>c(HCO![]() )=2c(CO
)=2c(CO![]() )
)
D. 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O![]() )+c(C2O
)+c(C2O![]() )+c(H2C2O4)]
)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:
A. 分子式为C7H8,分子中含有苯环的烃的一氯代物有4种
B. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
C. 如图所示实验可证明元素的非金属性:Cl>C>Si

D. C4H10的两种同分异构体因为分子间作用力大小不同,因而沸点正丁烷低于异丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中,R、W、X、Y、Z为元素周期表中前四周期的部分元素,下列有关叙述正确的是

A. 五种元素中,只有Z为金属元素
B. W位于ⅥA族,有+6、-2两种常见化合价
C. X和Y的最高价氧化物对应水化物都是强酸
D. X、Y、Z的气态氢化物的稳定性:Y>X>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+ △H>0。
CH3COO-+H+ △H>0。
(1) 下列方法中,可以使0.10 mol/L CH3COOH的电离程度增大的是_______(用序号填写)。
a.加入少量0.10 mol/L的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol/L d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol/L的NaOH溶液
(2) 将等质量的锌粒投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积关系为V(盐酸)_____V(醋酸)(填写“>”、“<”或“=").
(3)常温下,向体积为VamL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液VbmL至溶液恰好呈中性,则Va与Vb的关系为: Va______Vb(填写“>”、“<”或“=”)。
(4) 已知: 某温度时,水的离子积常数为Kw=1.0×10-12,在此温度下,将pH=1的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=_______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是聚合反应生产胶黏剂基料的单体,亦可作为合成调香剂I、聚酯材料J的原料,相关合成路线如下:

已知:在质谱图中烃A的最大质荷比为118,其苯环上的一氯代物共三种,核磁共振氢谱显
示峰面积比为3:2:2:2:1。
根据以上信息回答下列问题:
(1)A的官能团名称为__________________,B→C的反应条件为_____________,E→F的反应类型为_____________。
(2)I的结构简式为____________________,若K分子中含有三个六元环状结构,则其分子式为________________。
(3)D与新制氢氧化铜悬浊液反应的离子方程式为_______________________________。
(4)H的同分异构体W能与浓溴水反应产生白色沉淀,1 mol W参与反应最多消耗3 mol Br2,请写出所有符合条件的W的结构简式___________________________________。
(5)J是一种高分子化合物,则由C生成J的化学方程式为
______________________________________________________________________。
(6)![]() 已知:
已知:![]() (R为烃基)
(R为烃基)
设计以苯和乙烯为起始原料制备H的合成路线(无机试剂任选)。
[合成路线示例:]![]()
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.摩尔是国际科学界采用的一种物理量
B.摩尔是物质的量的单位,简称摩,符号为mol
C.我们把含有6.02×1023个物体的集体计量为1摩尔
D.1mol氧含6.02×1023个O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、钾号称肥料的“三要素”,化学肥料的施用,使农业增产增收,经济效益显著。但是化学肥料的滥施乱用也对环境产生了许多不良影响。请根据相关知识和信息回答下列问题:
(1)如图是某品牌化肥包装袋中的部分文字

①写出以氨为原料制取该化肥的各步化学方程式_______。
②关于该氮肥的处置和施用正确的方法是_______。
A.与草木灰混合施用
B.如果结块,可用铁锤敲击
C.与钙镁磷肥混合施用
D.在经常排灌水的稻田中施用肥效最高
③若该化肥的杂质中不含氮元素,则该化肥的纯度是_______。
(2)甲、乙、丙三个化肥厂生产尿素所用的原料不同,但生产流程相同:
![]()
①甲厂以焦炭和水为原料;②乙厂以天然气和水为原料;③丙厂以石脑油(主要成分为C5H12)和水为原料。按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算成H2的物质的量)和CO2的物质的量之比,则对原料的利用率最高。据此判断甲、乙、丙三个工厂哪个工厂对原料的利用率最高?_______。
(3)近年来“水华”和“赤潮”时有发生,据专家分析,是因水体富营养化造成的,试分析水体富营养化的原因_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-![]() FeO42-+3H2↑,其工作原理如图所示。下列叙述正确的是
FeO42-+3H2↑,其工作原理如图所示。下列叙述正确的是

A.电解一段时间后,阳极室的c(OH-)增大
B.Na+由阴极室移向阳极室
C.阴极反应式:2H2O+2e-=H2↑+2OH-
D.电解过程中,当消耗1 mol OH-时,同时生成33.6 L H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com