
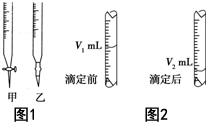
 现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:
现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:分析 (1)滴定管用蒸馏水洗涤后,还必须用待装液润洗,否则影响待装液的浓度;
(2)图1中甲为酸式滴定管,乙为碱式滴定管,氢氧化钠溶液为碱性溶液,应该用碱式滴定管盛放;
(3)根据图2中数据计算出消耗标准液体积,然后根据中和反应原理计算出待测液浓度.
解答 解:(1)碱式滴定管用蒸馏水洗净后,为了不影响氢氧化钠溶液的浓度,应该用标准NaOH溶液润洗2~3次,
故答案为:用标准NaOH溶液润洗2~3次;
(2)氢氧化钠溶液呈碱性,应该为碱式滴定管,图1中乙为碱式滴定管,所以应将标准NaOH溶液注入乙中,
故答案为:乙;
(3)根据图2可知,滴定过程中消耗待测液体积为:(V2-V1)mL,在待测液浓度为:c(HCl)=$\frac{n(NaOH)}{V[HCl(aq)]}$=$\frac{amol/L×({V}_{2}-{V}_{1})×1{0}^{-3}L}{V×1{0}^{-3}L}$=$\frac{a({V}_{2}-{V}_{1})}{V}$mol/L,
故答案为:$\frac{a({V}_{2}-{V}_{1})}{V}$.
点评 本题考查了中和滴定,题目难度不大,明确中和滴定操作方法为解答关键,注意掌握滴定管的构造、类型及使用方法,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 100mL12mol/L浓盐酸与足量的MnO2加热充分反应生成氯气分子数为0.3 NA | |
| B. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA | |
| D. | 5.4g铝粉与足量的氢氧化钠溶液充分反应生成氢气分子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 操作方法 | 实验现象 | 结论或解释 |
| 1 | 观察氯水的颜色 | 含有Cl2 | |
| 2 | 有无色气体产生 | 含有H+ | |
| 3 | 取少量氯水于试管中,加入稀硝酸酸化的硝酸银溶液 | 有白色沉淀生成 | |
| 4 | 取少量氯水于试管中,放入红色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | Fe3+ | Al3+ | Fe2+ |
| 开始沉淀的pH | 2.2 | 3.1 | 7.5 |
| 完全沉淀的pH | 3.5 | 5.4 | 9.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 溶液中的化学反应大多是离子反应.根据要求回答下列问题.
溶液中的化学反应大多是离子反应.根据要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、普通漏斗、玻璃棒、烧杯.
(1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、普通漏斗、玻璃棒、烧杯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
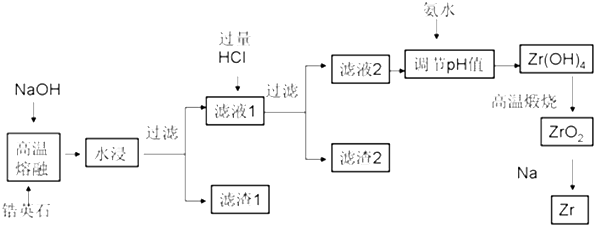
| 沉淀物 | Zr(OH)4 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时pH | 1.2 | 2.7 | 3.4 | 6.3 |
| 完全沉淀时pH | 2.4 | 3.2 | 5.2 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溶质物质的量之比为 2:7 的三氯化铝溶液和氢氧化钡溶液混合:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 向硫酸氢钠溶液中滴加 Ba(OH)2 至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 敞开体系,向FeCl2 溶液滴加NaOH 溶液:4Fe2++8OH-+O2+2H2O═4Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe( NO3)3溶液中加入过量HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 浓烧碱溶液中加入铝片:2A1+2OH-═2AlO2-+H2 | |
| C. | H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4+H2O | |
| D. | 将新制氢氧化铜悬浊液加入氨水中:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com