
| A. | Fe(OH)2溶于稀硝酸中 Fe(OH)2+3H+=Fe2++3H2O | |
| B. | H218O中投入Na2O2固体 2H218O+2O22-=4OH-+18O2↑ | |
| C. | 铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑ | |
| D. | 等体积等物质的量浓度的Ba(OH)2溶液与明矾溶液混合3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓ |
分析 A.稀硝酸具有强氧化性,能够将亚铁离子氧化成铁离子;
B.氧气中的氧元素完全来自过氧化钠,氧气中不会含有18O,且过氧化钠不能拆开;
C.离子方程式两边负电荷不相等,不满足电荷守恒;
D.氢氧化钡与硫酸铝钾的物质的量相等,氢氧根离子、钡离子不足,反应生成硫酸钡和氢氧化铝沉淀.
解答 解:A.氢氧化亚铁和稀硝酸发生氧化还原反应生成铁离子、NO和水,正确的离子方程式为:3Fe(OH)2+NO3-+10H+=3Fe3++NO↑+8H2O,故A错误;
B.Na2O2既是氧化剂有时还原剂,水没有参与氧化还原反应,18O应该在氢氧化钠中,其过氧化钠不能拆开,正确的离子方程式为:2H218O+2Na2O2=218OH-+2OH-+4Na++O2↑,故B错误;
C.铝片跟氢氧化钠溶液反应生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,故C错误;
D.等体积等物质的量浓度的Ba(OH)2溶液与明矾溶液混合,氢氧根离子、钡离子不足,反应生成硫酸钡和氢氧化铝沉淀,反应的离子方程式为:3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓,故D正确;
故选D.
点评 本题考查了离子方程式书写判断,题目难度中等,注意掌握离子方程式的书写原则,明确判断离子方程式正误常用方法,B为易错点,注意Na2O2既是氧化剂有时还原剂,水没有参与氧化还原反应,18O应该在氢氧化钠中.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:解答题
时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④正确 | B. | ①③正确 | C. | ②④正确 | D. | 只有①正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑥ | B. | ②④⑤ | C. | ①③⑥ | D. | ①②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,取代反应.
,取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量比为1:1 | B. | 质量之比为28:9 | ||
| C. | 物质的量之比为2:3 | D. | 物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
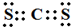 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z为0.3 mol•L-1 | |
| B. | X2为0.15 mol•L-1,Z为0.1 mol•L-1 | |
| C. | c(X2)+c(Y2)+c(Z)=0.6 mol•L-1 | |
| D. | c(X2)+c(Y2)+c(Z)=0.55 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com