
用含有少量银和锌的粗铜做阳极,纯铜片做阴极,CuSO4溶液做电解液,电解一段时间后,阳极减少的Cu的质量为m g,则()
A. 电解液质量增加m g B. 阴极质量增加a g,a>m
C. 阴极质量增加m g D. 阴极质量增加b g,b<m
考点: 电解原理.
专题: 电化学专题.
分析: 用含少量银和锌的粗铜做阳极,电极反应为:Zn﹣2e﹣=Zn2+,Cu﹣2e﹣=Cu2+,纯铜片做阴极,Cu2++2e﹣=Cu,CuSO4溶液做电解液,电解一段时间后,阳极减少的Cu的质量为mg,则锌也溶解减少了,依据电子守恒分析,则阴极析出的铜大于mg.
解答: 解:电解精炼中,粗铜作阳极,纯铜作阴极,阳极上铜、锌失电子发生氧化反应,电极反应式为:Zn﹣2e﹣=Zn2+,Cu﹣2e﹣=Cu2+,纯铜片做阴极,Cu2++2e﹣=Cu,CuSO4溶液做电解液,电解一段时间后,阳极减少的Cu的质量为mg,则锌也溶解减少了,依据电子守恒分析,则阴极析出的铜大于mg,阴极质量增加a g,且a>m,
故选B.
点评: 本题考查了电解原理的分析应用,主要是电解精炼原理的理解,电极反应电子守恒的分析判断是解题关键,题目难度中等.


科目:高中化学 来源: 题型:
一定条件下,在一个容积为2L的密闭容器中加入0.8mol A2气体和0.6mol B2气体反应达平衡生成1mol AB气体并释放出热量,反应中各物质的浓度随时间的变化情况如图所示.下列说法不正确的是()
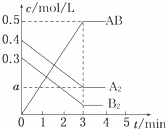
A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()
A. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=﹣4b kJ/mol
B. C2H2(g)+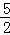 O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
C. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=2b kJ/mol
D. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=b kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
电解CuCl2和NaCl的混合溶液,阴极和阳极上最先分别析出的物质是()
A. H2和Cl2 B. Cu和Cl2 C. H2和O2 D. Cu和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,取一定质量的硫酸铜溶液,用石墨做电极进行电解,当阳极产生标况下气体1.12L时,CuSO4恰好被完全电解,得到密度为1.2g•cm﹣3的溶液200mL.求:
(1)电解后所得溶液的为 .
(2)电解前所取CuSO4溶液的质量为 g.
(3)若要使电解后所得溶液恢复至电解前的原状态,需要加入何种物质(只要求写出一种),其化学式为CuO,加入物质的质量为 g.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A. 由元素的原子序数推测其在元素周期表中的位置
B. 由H-H和Cl-Cl的键长推测液氢和液氯沸点的高低
C. 由CaF2晶体中,与Ca2+距离最近的F-有8个,推知与F-距离最近的Ca2+也有8个
D. 由N-N、H-H、N-H的键能数据估算3H2(g)+N2(g)  2NH3(g)的反应热
2NH3(g)的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生探究AgCl、Ag2S沉淀转化的原因。
| 步 骤 | 现 象 |
| Ⅰ.将NaCl与AgNO3溶液混合 | 产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
| Ⅲ.滤出黑色沉淀,加入NaCl溶液 | 较长时间后,沉淀变为乳白色 |
(1)Ⅰ中的白色沉淀是 。
(2)Ⅱ中能说明沉淀变黑的离子方程式是 ,沉淀转化的主要原因是 。
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl。用浓HNO3溶解,产生红棕色气体,部分沉淀未溶解,过滤得到滤液X和白色沉淀Y。
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀
ⅱ.向Y滴加KI溶液,产生黄色沉淀
①由ⅰ判断,滤液X中被检出的离子是 。
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀______。
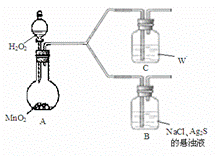
(4)该学生通过如下对照实验确认了步骤Ⅲ中乳白色沉淀产生的原因:在NaCl存在下,氧气将Ⅲ中黑色沉淀氧化。
| 现 象 | B:一段时间后,出现乳白色沉淀 |
| C:一段时间后,无明显变化 |
①A中产生的气体是_________。
②C中盛放的物质W是_________。
③该同学认为B中产生沉淀的反应如下(请补充完整):
2Ag2S + 
 +
+ 
 + 2H2O
+ 2H2O 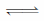 4AgCl +
4AgCl +
 + 4NaOH
+ 4NaOH
④B中NaCl的作用是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com