

| ||
| 12 |
| 44 |
| 3(m1+m2) |
| 11 |
| 3(m1+m2) |
| 11 |


科目:高中化学 来源: 题型:阅读理解
2- 4 |

2- 4 |
查看答案和解析>>
科目:高中化学 来源:福建省福州三中2012届高三第二次月考化学试题 题型:058
实验室需要0.10 mol/L NaOH溶液475 mL和0.40 mol/L.硫酸溶液500 mL.根据这两种溶液的配制情况回答下列问题:
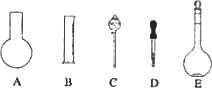
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称).
(2)人们常将配制过程简述为以下各步骤:
A.冷却
B.称量
C.洗涤
D.定容
E.溶解
F.摇匀.
G.移液
其正确的操作顺序应是________(填各步骤序号).
(3)计算该实验用托盘天平称取NaOH的质量为________g.在实验中其他操作均正确,若定容时俯视视刻度线,、则所得溶液浓度________0.1 mol/L(填“大下”、“等于”或“小于”,下同).若移液时,容量瓶内已有少许蒸馏水,则所得溶液浓度________0.1 mol/L.
(4)根据计算得知,所需质量分数A 98%、密度为1184 g/cm3的浓硫酸的体积为________mL(保留一位小数).
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省高三上学期第三次月考化学试卷 题型:实验题
(10分)实验室需要0.10 mol/L NaOH溶液475mL和0.40 mol/L。硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
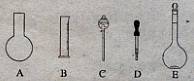
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。
(2)人们常将配制过程简述为以下各步骤:
A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀。 G.移液
正确的操作顺序应是 (填各步骤序号)。
(3)计算该实验用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若定容时俯视视刻度线,、则所得溶液浓度 0.lmol/L(填“大下”、“等于”或“小于”,下同)。若移液时,容量瓶内已有少许蒸馏水,则所得溶液浓度 0.lmol/L。
(4)根据计算得知,所需质量分数A 98%、密度为1184g/cm3的浓硫酸的体积为____mL(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
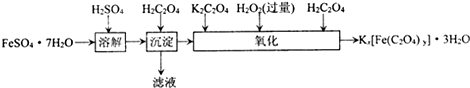
 含量的实验步骤如下:
含量的实验步骤如下:
 全部氧化成CO2,Fe2+全部氧化成Fe3+记录体积.
全部氧化成CO2,Fe2+全部氧化成Fe3+记录体积.查看答案和解析>>
科目:高中化学 来源:2012年江苏省南京盐城市高考化学三模试卷(解析版) 题型:解答题
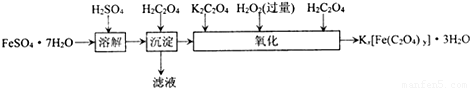
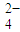 含量的实验步骤如下:
含量的实验步骤如下: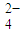 全部氧化成CO2,Fe2+全部氧化成Fe3+记录体积.
全部氧化成CO2,Fe2+全部氧化成Fe3+记录体积.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com