
| A. | 6.4g | B. | 4.8g | C. | 17.6g | D. | 20.2g |
分析 由2Fe3++Cu═2Fe2++Cu2+和“所得溶液中不含Fe3+”可知,Fe2O3的物质的量与铜的物质的量相等,设出物质的量为x,然后根据氧化铁和铜的质量列式计算二者的物质的量,再根据用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为氧化铁中氧元素质量,以此计算.
解答 解:由2Fe3++Cu═2Fe2++Cu2+和“所得溶液中不含Fe3+”可知,Fe2O3的物质的量与铜的物质的量相等,
设二者的物质的量都为xmol,则有160x+64x=22.4g,解得x=0.1mol,
用一氧化碳还原时,固体质量损失的是氧化铁中O的质量,0.1mol氧化铁中含有0.3molO,
则固体减少质量为m(O)=0.3mol×16g/mol=4.8g,
剩余固体为Fe、Cu,其质量为22.4g-4.8g=17.6g,
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意剩余固体为Fe、Cu的混合物,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A | B | C | D |
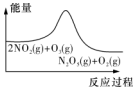 |  |  |  |
| 平衡后升温,NO2含量降低 | 0~2s内,v(O2)=0.2mol•L-1•s-1 | v正:b点>a点,b点:v逆>v正 | 恒温,t1时再充入O3 |
| A. | .A. | B. | .B | C. | .C | D. | .D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 •H2O | B. | Na2CO3 •2H2O | C. | Na2CO3 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
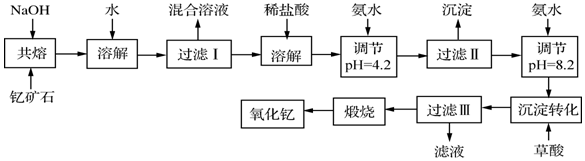
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取样,加少量AgNO3溶液,有白色沉淀;再加稀硝酸,看白色沉淀是否消失 | |
| B. | 取样,先加盐酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| C. | 取样,先加稀硫酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| D. | 取样,滴加AgNO3溶液,看是否有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸pH=a,加水稀释到10n倍,则pH=a+n | |
| B. | 弱酸pH=a,加水稀释到10n倍,则pH<a+n(a+n<7) | |
| C. | 强碱pH=b,加水稀释到10n倍,则pH=b-n | |
| D. | 弱碱pH=b,加水稀释到10n倍,则pH=b-n(b-n>7) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中先滴加氯水,再滴加KSCN溶滚,溶液显血红色,说明原溶液中含有Fe3+ | |
| B. | 向某溶液中滴加过量氨水,先有白色沉淀产生,然后沉淀溶解,说明原溶液中含有Al3+ | |
| C. | 向某溶液中滴加Ca(OH)2溶液,得到白色沉淀,说明原溶液中含有CO32- | |
| D. | 向某溶液中滴加过量NaOH溶液,得到蓝色沉淀,说明原溶液中含有Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向Al2(SO4)3溶液中滴加过量氨水 | 溶液先浑浊后澄清 | Al(OH )3能溶于氨水 |
| B | 将浓硫酸滴在胆矾晶体上 | 蓝色晶体变白 | 浓硫酸具有脱水性 |
| C | 将新制的氯水滴在蓝色石蕊试纸上 | 试纸先变红后褪色 | Cl2有漂白性 |
| D | 向某晶体的水溶液中加入2滴FeSO4溶液 | 产生特征蓝色沉淀 | 该晶体中一定含有[F e(CN)6]3- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com