
| A. | 2NA个H2O | B. | 常温常压下,48g O2 | ||
| C. | 标准状况下,22.4L H2 | D. | 0.5mol CO2 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”可以生产“生物燃料”,生物燃料本质上能量来源于太阳能 | |
| B. | 消除水体中的HgCl2污染可利用微生物使其转化为有机汞CH3HgCl | |
| C. | 人体内没有能使纤维素水解成葡萄糖的酶,但可以加强胃肠蠕动,有助于消化,因此纤维素是人类的营养食物 | |
| D. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是经提纯的二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | a mol•L-1HCN溶液与b mol•L-1NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于或等于b | |
| C. | HCN与Na2S溶液一定不能发生反应 | |
| D. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 前四周期原子序数依次增大的六种元素A,B,D,X,Y,Z,基态时核外电子排布具有以下特征:A的电子层数和最外层电子数相等,非金属元素B的已成对电子数是未成对电子数的2倍,且A和B位于不同周期;D和X的价电子层中未成对电子均只有1个,并且D-和X+的电子相差为8;Y、Z与X位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的六种元素A,B,D,X,Y,Z,基态时核外电子排布具有以下特征:A的电子层数和最外层电子数相等,非金属元素B的已成对电子数是未成对电子数的2倍,且A和B位于不同周期;D和X的价电子层中未成对电子均只有1个,并且D-和X+的电子相差为8;Y、Z与X位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
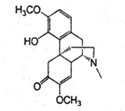
| A. | 每个青藤碱分子中含有2个手性碳原子 | |
| B. | 1mol最多能与1molBr2发生反应 | |
| C. | 1mol最多能与4molH2发生反应 | |
| D. | 青藤碱既能与盐酸反应又能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂和蛋白质都是天然高分子化合物,都能水解 | |
| B. | 天然气和液化石油气的主要成分都是烃,都能燃烧 | |
| C. | 苯和乙烯都含有碳碳双键,都能和H2发生加成反应 | |
| D. | 裂化汽油和四氯化碳都不溶于水,都可用于萃取溴 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com