
| Kw |
| 0.2 |


科目:高中化学 来源: 题型:
| A、当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发) |
| B、水电离的热化学方程式为:H2O(1)?H+(aq)+OH-(aq)△H=+57.3kJ/mol |
| C、当c>0.1时,一定不存在:c(Na+)=c(F-) |
| D、若混合后溶液中:c(Na+)>c(OH-)>c(F-)>c(H+),则c一定小于0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C5H12 |
| B、C4H10 |
| C、C3H8 |
| D、C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用稀硝酸清洗做过银镜反应的试管 |
| B、用稀盐酸清洗做高锰酸钾分解实验的试管 |
| C、用氢氧化钠溶液清洗盛过硅酸的试管 |
| D、用四氯化碳清洗做过碘升华的烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
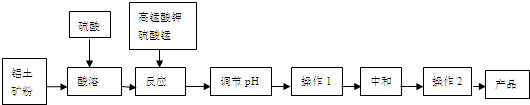
| n(MnO2) |
| n(Fe) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com