

 H++H2PO2-;(2)①+1;②H3PO4;③正盐 弱碱性;
H++H2PO2-;(2)①+1;②H3PO4;③正盐 弱碱性; H++H2PO2-;(2)①根据化合物中正负化合价的代数和为0,H是+1价,O是-2价。所以在H3PO2中P元素的化合价为+1价。②根据题意结合电子守恒、原子守恒可知:氧化产物为H3PO4,还原产物是Ag。③根据元素的化合价及电离情况可知H3PO2的结构是
H++H2PO2-;(2)①根据化合物中正负化合价的代数和为0,H是+1价,O是-2价。所以在H3PO2中P元素的化合价为+1价。②根据题意结合电子守恒、原子守恒可知:氧化产物为H3PO4,还原产物是Ag。③根据元素的化合价及电离情况可知H3PO2的结构是 ,所以NaH2PO2是正盐;由于该盐是强碱弱酸盐,所以该溶液显弱碱性。(3)根据题意可得白磷与氢氧化钡溶液反应的化学方程式是2P4+3Ba(OH)2+ 6H2O= 3Ba(H2PO2)2 +3PH3↑;(4)①在阳极由于含有的阴离子OH-、SO42-、H2PO2-中放电能力最强的是OH-,所以发生反应: 2H2O-4e-=O2↑+4H+;②在产品室只所以可得到H3PO2是因为阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO3-穿过阴膜扩散至产品室,二者反应生成)③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是阳极产生的氧气会把H3PO3或H2PO2-氧化为PO43-,是产品不纯。
,所以NaH2PO2是正盐;由于该盐是强碱弱酸盐,所以该溶液显弱碱性。(3)根据题意可得白磷与氢氧化钡溶液反应的化学方程式是2P4+3Ba(OH)2+ 6H2O= 3Ba(H2PO2)2 +3PH3↑;(4)①在阳极由于含有的阴离子OH-、SO42-、H2PO2-中放电能力最强的是OH-,所以发生反应: 2H2O-4e-=O2↑+4H+;②在产品室只所以可得到H3PO2是因为阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO3-穿过阴膜扩散至产品室,二者反应生成)③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是阳极产生的氧气会把H3PO3或H2PO2-氧化为PO43-,是产品不纯。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:多选题
| A.次氯酸的电离方程式:HClO?H++ClO- |
| B.只有熵增加的过程才能自发进行 |
| C.HS-水解离子方程式:HS-+H2O?H3O++S2- |
| D.已知中和热为57.3kJ?mol-1,稀硫酸与氢氧化钠稀溶液反应的热化学方程式:H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3COO一+H+,对于该平衡,下列叙述不正确的是 ( )
CH3COO一+H+,对于该平衡,下列叙述不正确的是 ( )| A.加入水时,平衡向正反应方向移动,溶液中n(H+)增大 |
| B.加入少量冰醋酸,平衡向正反应方向移动,溶液中c(H+)增大 |
| C.加入少量0.1 mol·L-HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向逆反应方向移动,溶液中c(H+)减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通入CO2,溶液pH减小 |
B.加入NaOH固体,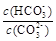 增大 增大 |
| C.由水电离的c(OH-) = 1×10-10 mol.L-1 |
| D.溶液中:c(CO32-)>c(OH-)>c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1 mol·L-1CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1 |
| B.浓度均为0.1 mol·L-1 Na2CO3溶液和稀盐酸等体积混合后的溶液中: c(CO 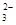 )+c(OH-)=c(H+)+c(H2CO3) )+c(OH-)=c(H+)+c(H2CO3) |
| C.25 ℃时,pH=9.4、浓度均为0.1 mol·L-1的HCN与NaCN的混合溶液中: c(Na+>c(CN-)>c(HCN)>c(OH-) |
| D. 3.0 L 0.1 mol·L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中: |
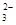 )>c(HCO
)>c(HCO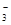 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.HA是强酸 |
| B.该混合液pH=7 |
| C.图中x表示HA,Y表示OH-,Z表示H+ |
| D.该混合溶液中:c(A-)+c(Y)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.稀醋酸溶解石灰石的离子方程式为 CaCO3+2H+=Ca2++H2O+CO2↑ |
| B.稀醋酸加水稀释后,溶液中c(CH3COO-)/c(CH3COOH)变大 |
| C.向稀醋酸中加入等浓度的NaOH溶液,导电能力变化如右图 |
| D.CH3COONH4溶液和K2SO4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在稀盐酸中 c(H+)=c(Cl—)+c(OH—) |
B.常温下,在0.1mol/L的HNO3溶液中由水电离出的c(H+)<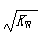 |
| C.将Na2CO3水溶液加热、蒸干,最后得到NaOH固体 |
| D.酸与碱完全中和,所得溶液的pH可能大于7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
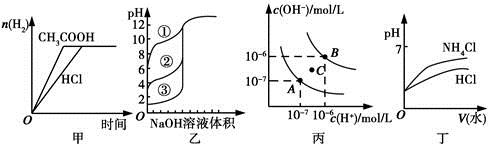
| A.图甲中曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉,产生H2的物质的量的变化 |
| B.图乙表示用0.1000 mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由曲线可确定③的酸性最强 |
| C.图丙为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
| D.图丁表示将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数时,二者pH的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com