
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol SO2、1mol O2 | 2mol SO3 | m mol SO2、n mol O2、p mol SO3 |
| c(SO3)/mol•L-1 | 1.4 | 1.4 | 1.4 |
| 能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| SO2或SO3的转化率 | α1 | α2 | 12.5% |
分析 恒温恒容下,甲、乙、丙中起始投料量不同,平衡时三氧化硫浓度均为1.4mol/L,为完等效平衡,按化学计量数转化到左边满足n(SO2)-2mol、n(O2)=1mol,平衡时同种组分的物质的量相等,体积均为1L,最终n(SO3)=1.4 mol,丙中吸收热量,反应逆向进行建立平衡,再结合SO3的转化率为12.5%计算p的值,进而计算丙中转化的三氧化硫物质的量,再结合热化学方程式计算c;
根据甲容器计算各组分物质的量变化量、平衡时各组分物质的量,可以计算甲、乙中转化率,结合热化学方程式计算b,进而得到甲、乙中转化率之和及热量b、c之和.
解答 解:恒温恒容下,甲、乙、丙中起始投料量不同,平衡时三氧化硫浓度均为1.4mol/L,为完等效平衡,按化学计量数转化到左边满足n(SO2)-2mol、n(O2)=1mol,平衡时同种组分的物质的量相等,体积均为1L,最终n(SO3)=1.4 mol,丙中吸收热量,反应逆向进行建立平衡,
甲容器:2SO2(g)+O2(g)?2SO3(g)
起始量(mol):2 1 0
变化量(mol):1.4 0.7 1.4
变化量(mol):0.6 0.3 1.4
则α1=$\frac{1.4mol}{2mol}$=0.7,
乙容器:α2=$\frac{2mol-1.4mol}{2mol}$=0.3,b=98.3kJ×=$\frac{2mol-1.4mol}{2mol}$=29.49kJ,
丙容器:p=1.4÷(1-12.5%)=1.6,则转化的三氧化硫为1.6mol-1.4mol=0.2mol,故c=98.3kJ×$\frac{0.2mol}{2mol}$=9.83kJ,
故α1+α2=0.7+0.3=1,b+c=29.49+9.83=39.32,
故答案为:1;1.6;39.32.
点评 本题考查化学平衡计算,关键是理解等效平衡规律:1、恒温恒容,反应前后气体体积不等,按化学计量数转化到一边,对应物质满足等量;反应前后气体体积相等,按化学计量数转化到一边,对应物质满足等比,2:恒温恒压,按化学计量数转化到一边,对应物质满足等比.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | FeCl2 | B. | KNO3 | C. | FeSO4 | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对症下药是合理用药的首要原则 | |
| B. | 能被充分、快速吸收而无刺激性的药物,可在饭前口服 | |
| C. | 服药一般用温开水,止咳糖浆也可用水冲服 | |
| D. | 一种药物的用量,是经过严格的科学实验和大量的临床研究确定的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
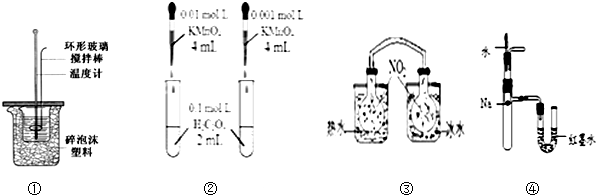
| A. | 装置①用于测定中和热装置 | |
| B. | 装置②依据褪色快慢比较浓度对反应速率的影响 | |
| C. | ③依据两容器内气体颜色变化,判断反应2NO2(g)?N2O4(g)平衡移动的方向 | |
| D. | 装置④依据U管两边液面的高低判断Na和水反应的热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢气是一种新型的绿色能源,又是一种重要的化工原料.
氢气是一种新型的绿色能源,又是一种重要的化工原料.| 化学键 | H-H | O=O | O-H |
| 键能(kJ•mol-1) | X | 496.4 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2 Na2CO3 盐酸 AgNO3 | |
| B. | BaCl2 Na2CO3 AgNO3 盐酸 | |
| C. | Na2CO3盐酸 AgNO3 BaCl2 | |
| D. | AgNO3盐酸 BaCl2 Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 电解质 | 非电解质 | 化合物 | |
| A | H2SO4 | Cl2 | NaCl |
| B | NaOH | 酒精 | N2 |
| C | CuSO4 | 水银 | CO2 |
| D | BaSO4 | 蔗糖 | KClO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com