
镁粉加入到很稀的硝酸中发生反应:4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O在该反应中被还原的硝酸和未被还原的硝酸的物质的量比为 ( )
A.4:10 B.1:9 C.1:5 D.1:7
 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源:2015-2016学年甘肃省高二上期末考试化学试卷(解析版) 题型:选择题
m molC2H2跟n molH2在密闭容器内反应,当其达到平衡时,生成p molC2H6。将平衡混合气体完全燃烧,所需O2物质的量是
A.(3m+n)mol B.(  )mol C.(3m+n+2p)mol D.
)mol C.(3m+n+2p)mol D. 
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三上一轮复习检测一化学试卷(解析版) 题型:选择题
分类是科学研究的重要方法,下列物质分类不正确的是
A.化合物:干冰,冰水混合物,烧碱,小苏打
B.非电解质:乙醇,四氯化碳,氯气,葡萄糖
C.同素异形体:活性炭,C60,石墨烯,金刚石
D.混合物:铝热剂,纯净矿泉水,水玻璃,漂白粉
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上期末考试化学试卷(解析版) 题型:填空题
海水中蕴藏着丰富的资源,海水综合利用的流程图如下:
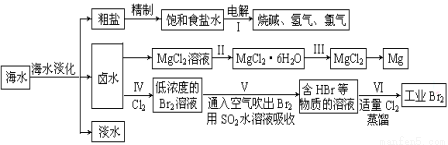
(一)某化学研究小组用右图装置模拟步骤I电解食盐水(用铁和石墨做电极)。
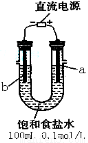
(1)a电极材料是 (填铁、石墨),其电极反应式为 。
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为 (忽略反应前后溶液体积的变化)。
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+。下表是生成氢氧化物沉淀的pH:
物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,可选用的物质是______________(填序号,下同),加入
调节溶液的pH,充分反应后过滤,可得MgCl2溶液。
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2·H2O获得MgCl2的操作是: 。
(三)制取工业溴:
(5)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是 。
(6)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期末考试化学试卷(解析版) 题型:选择题
若NA表示阿伏加德罗常数,下列说法中,正确的是( )
A.3mol NO2与足量H2O反应,转移的电子数为NA
B.在0 ℃,101 kPa时,22.4 L氢气中含有NA个氢原子
C.25 ℃,1.01×105 Pa,64 g SO2中含有的原子数为3 NA
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末化学试卷(解析版) 题型:实验题
(一)酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法。某学生用0.1032 mol·L-1的氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取25.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准NaOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________。
(2)重复三次的实验数据如下表所示:
实验序号 | 消耗0.1032 mol·L-1的氢氧化钠溶液的体积/mL | 待测盐酸溶液的体积/mL |
1 | 28.84 | 25.00 |
2 | 27.83 | 25.00 |
3 | 27.85 | 25.00 |
则待测HCl的物质的量浓度是________mol·L-1。
(3)滴定至终点的现象是 。
(4)下列操作中可能使所测盐酸的浓度数值偏低的是 。
A.碱式滴定管未用标准溶液润洗就直接注入标准液
B.滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数
(5)若用同浓度的氨水与同浓度的盐酸混合至二者恰好完全中和时,该溶液中离子浓度大小关系为 。
(二)从海水中提取溴的工业流程如图:
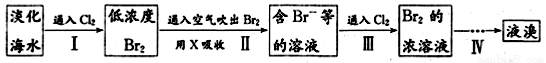
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是 。
(2)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一上期末化学试卷(解析版) 题型:填空题
将0.1 mol的镁、铝混合物溶于100 mL 2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化的关系如右图所示。

当V1=140 mL时,则金属粉末中:n(Mg) =________ mol,V2=______ ml。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=____________mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a ,用100 mL 2 mol·L-1 的H2SO4 ,再加入480 mL 1 mol·L-1 的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末化学试卷(解析版) 题型:选择题
下列盐溶液中呈酸性的是( )
A. NaCl B. CH3COONa C.FeC13 D.NaHCO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一上学期12月月考化学试卷(解析版) 题型:选择题
最近美国宇航局的科研人员确认火星地表含有溶有高氯酸盐的液态水。下列有关水及高氯酸盐的说法错误的是
A.水是一种弱电解质 B.NH4ClO4溶液显酸性
C.NaClO4中含有离子键和共价键 D.NH4ClO4只有氧化性,没有还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com