
将6.4 g金属铜放入10.9 mL 98% 硫酸(密度为1.84 g / cm3 )中,加热反应后产生气体的质量为( )
A.等于6.4 g B.小于6.4 g
C.大于6.4 g D.不能确定
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源:2013-2014学年江西省协作体高三第一次联考理综化学试卷(解析版) 题型:填空题
元素及其化合物在生产、生活中具有广泛的用途。
Ⅰ.铬化学丰富多彩.
(1)在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液。 与铜相比,其金属活泼性?????? (填“强”或“弱”);
⑵Cr( OH)3和Al( OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,其酸式电离方程式是?????????????????????????? ;
⑶工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放人电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知KsP[ Fe(OH)3]=4.0×10-38,KsP[Cr(OH)3]=6.0×l0-31)。已知电解后的溶液中c( Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为??????????? mol/L。
Ⅱ.物质A~H有如图所示转化关系(部分生成物未列出)。A、E、F、G均为气体,D为金属单质。
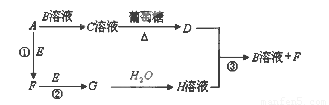
请回答下列问题:
(1)A的电子式为???????? D的化学式?????????? ,C溶液的名称是??????????????????? 。
(2)反应①的化学方程式为?????????????????????????????? ;
反应③的离子方程式为?????????????????????????????????? 。
查看答案和解析>>
科目:高中化学 来源:2015届山东济宁市高二上学期期中考试化学试卷(解析版) 题型:实验题
现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
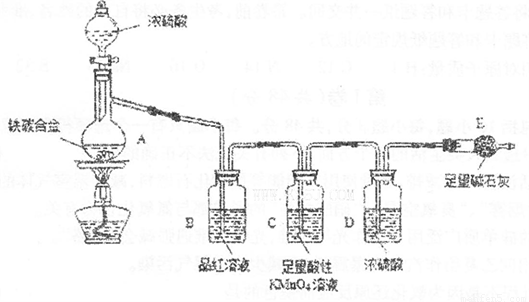
I.测定铁的质量分数:
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根
导管,然后________________________________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。铁碳合金中铁的质量分数为_____________________________________________(写表达式)。
(3)装置C中反应的离子方程式为________________________________________。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、H2O进入E管使b增大。你认为改进的方法是____________________________________.
(5)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁的质量分
数也可能会偏离。你认为其中的原因是_________________________________________。
Ⅱ.探究浓硫酸的某些性质:
(6)往A中滴加足量的滚硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
_____________________________________________________________________。
(7)将A中固体换为金属铜则与浓硫酸发生反应的化学方程式是__________________
_______________________,反应中浓硫酸表现出的性质是______________________。
查看答案和解析>>
科目:高中化学 来源:江苏模拟题 题型:填空题
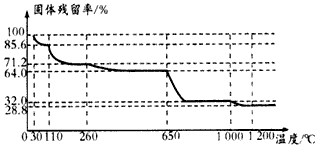
查看答案和解析>>
科目:高中化学 来源:重庆一中2012级高一2010年4月月考 题型:单选题
将6.4 g金属铜放入10.9 mL 98% 硫酸(密度为1.84 g / cm3 )中,加热反应后产生气体的质量为( )
A.等于6.4 g B.小于6.4 g
C.大于6.4 g D.不能确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com