
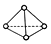
 ,它是一种非极性分子.(填“极性”或“非极性”)
,它是一种非极性分子.(填“极性”或“非极性”)分析 (1)氮原子为7号元素有两个电子层,最外层5个电子,据此书写最外层电子排布式;氮离子(N3-)最外层8个电子,结合核外电子排布分析运动状态不同的电子,子核外没有两个运动状态完全相同的电子,有几个电子就有几种运动状态,N4分子与P4结构相似,为正四面体构型,N4分子中N原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,每个面为正三角形;
(2)只要确定一水合氨在水溶液里部分电离就能证明一水合氨是弱电解质,可选用酚酞作指示剂,然后向滴入酚酞的一水合氨溶液中加入醋酸铵,若溶液颜色变浅,则证明氨水中存在电离平衡,从而证明NH3•H2O是弱碱;
(3)向100mL 0.1mol/L的盐酸中通入0.02mol氨气,发生反应生成氯化铵,得到等浓度的NH3•H2O和NH4Cl混合溶液,充分吸收后测得溶液呈碱性,一水合氨电离大于铵根离子水解;
(4)铵盐与碱反应生成氨气,能使湿润的红色石蕊试纸变蓝;
(5)叠氮化钠(NaN3)撞击后30毫秒内迅速分解为两种单质,由质量守恒定律,反应前后元素种类不变,两种单质为钠和氮气,写出反应的化学方程式即可,结合化学方程式定量关系计算电子转移数.
解答 解:(1)氮原子为7号元素有两个电子层,最外层5个电子,据此书写最外层电子排布式为:2s22p3;氮离子(N3-)最外层8个电子,结合核外电子排布分析运动状态不同的电子,原子核外没有两个运动状态完全相同的电子,有几个电子就有几种运动状态,氮离子(N3-)核外有 10种运动状态不同的电子,N4分子与P4结构相似,为正四面体构型,N4分子中N原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,每个面为正三角形,为非极性分子,
故答案为:2s22p3;10;非极性;
(2)若证明一水合氨在水溶液里部分电离,则说明一水合氨是弱电解质,
所以选用试剂为:酚酞、醋酸铵、一水合氨,
操作方法及现象为:取少量氨水于试管中,滴加酚酞试液,溶液呈红色;向试管中加入少量醋酸铵晶体,振荡,由于铵根离子浓度增大,则溶液中氢氧根离子浓度减小,则溶液的红色变浅,根据现象可知:氨水中存在电离平衡,证明氨水是弱碱,
故答案为:取少量氨水于试管中,滴加酚酞试液,溶液呈红色;向试管中加入少量醋酸铵晶体,振荡,由于铵根离子浓度增大,则溶液中氢氧根离子浓度减小,则溶液的红色变浅,证明氨水是弱碱;
(3)向100mL 0.1mol/L的盐酸中通入0.02mol氨气,发生反应生成氯化铵,得到等浓度的NH3•H2O和NH4Cl混合溶液,充分吸收后测得溶液呈碱性,一水合氨电离大于铵根离子水解,溶液中NH3•H2O、NH4+、Cl-三种微粒的物质的量浓度大小关系为:NH4+>Cl->NH3•H2O,
故答案为:NH4+>Cl->NH3•H2O;
(4)铵盐与碱反应生成氨气,而氨气是唯一的碱性气体,能使湿润的红色石蕊试纸变蓝,故向某溶液加入NaOH并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体,即该气体为氨气,则该溶液中一定含有NH4+,
故答案为:湿润的红色石蕊试纸变蓝;
(5)叠氮化钠(NaN3)撞击后30毫秒内迅速分解为两种单质,由质量守恒定律,反应前后元素种类不变,两种单质为钠和氮气,反应的化学方程式为:2NaN3 $\frac{\underline{\;撞击\;}}{\;}$2Na+3N2,生成3molN2电子转移2mol,
故答案为:2NaN3 $\frac{\underline{\;撞击\;}}{\;}$2Na+3N2;2.
点评 本题考查了核外电子个数与电子运动状态种类之间的关系、强弱电解质的判断方法、离子检验、电解质溶液中离子浓度大小比较、氧化还原反应电子转移计算等,掌握基础是解题关键,题目难度中等.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 随着原子序数的增大,元素的主要化合价逐渐增加 | |
| B. | 随着随着相对原子质量的增大,元素的化学性质会不断重复 | |
| C. | 与碱金属相比,其相邻主族的(碱土)金属具有更小的密度和硬度 | |
| D. | 卤素氢化物的稳定性随着核电荷数的增加而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 回收废旧电池的首要原因是回收石墨 | |
| B. | pH在5.6~7.0之间的降水通常称为酸雨 | |
| C. | 焚烧一次性饭盒可减少白色污染 | |
| D. | 燃煤时加适量的生石灰可减少二氧化硫的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了防止白色污染应回收废旧塑料并加以焚烧 | |
| B. | 手机壳上贴的碳纤维膜是一种新型无机非金属材料 | |
| C. | 当今雾霾天气频发是由于人类活动对自然环境的影响所造成的 | |
| D. | 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
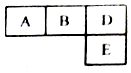 有M、A、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37.下列说法不正确的是( )
有M、A、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37.下列说法不正确的是( )| A. | 沸点:M2D>BM3>AM4 | |
| B. | 原子半径:rE>rA>rB>rD | |
| C. | 化合物AnM2n分子中既含有极性鍵又含有非极性鍵 | |
| D. | B元素的氢化物与D元素的单质在一定条件下能发生置换反应,且氧化剂与还原剂的物质的量之比为4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O | |
| C. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| D. | 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
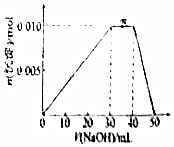
| A. | 当加入50mLNaOH时,溶液中的溶质为NaAlO2 | |
| B. | m点反应的离子方程式:NH4++OH-═NH3•H2O | |
| C. | NH4Al(SO4)2溶液中离子浓度由大到小的顺序是:c(SO42-)>c(Al3+)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 若向NH4Al(SO4)2溶液改加20mL1.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为0.02mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
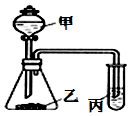 利用如图所示装置,采用适当试剂可完成下表的探究实验,并得出相应的实验结论,其中错误的是( )
利用如图所示装置,采用适当试剂可完成下表的探究实验,并得出相应的实验结论,其中错误的是( )| 选项 | 甲 | 乙 | 丙 | 装置丙中的现象 | 实验结论 |
| A | 稀硝酸 | 碳酸钾 | 澄淸石灰水 | 变浑浊 | 酸性:HNO3>H2CO3 |
| B | 稀硫酸 | 碳酸钠 | 次氯酸钙溶液 | 白色沉淀 | 酸性:H2CO3>HClO |
| C | 浓盐酸 | 大理石 | 硅酸钠溶液 | 白色沉淀 | 非金属性:C>Si |
| D | 浓盐酸 | 高锰酸钾 | 石蕊溶液 | 先变红后褪色 | 氯水既有酸性,又具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com