
【题目】回答问题。
(1)用双线桥法标明电子转移的方向和数目。
①2Al+Fe2O3![]() 2Fe+Al2O3:________;
2Fe+Al2O3:________;
②MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O:________;
MnCl2+Cl2↑+2H2O:________;
(2)在②中氧化剂是________ ,还原剂是_________,被氧化的元素是_____,被还原的元素是______,氧化剂与还原剂之比是___________,当有71gCl2生成时,被氧化的HCl的物质的量是________mol。
【答案】 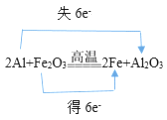
 MnO2 HCl Cl Mn 1:2 2
MnO2 HCl Cl Mn 1:2 2
【解析】试题分析:(1) ①2Al+Fe2O3![]() 2Fe+Al2O3的反应中,铝元素失去6个电子,铁元素得到6个电子;②MnO2+4HCl(浓)
2Fe+Al2O3的反应中,铝元素失去6个电子,铁元素得到6个电子;②MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O的反应中,氯元素失去2个电子,锰元素得到2个电子;(2)根据化合价变化,判断氧化剂、还原剂、被氧化的元素、被还原的元素;根据化合价变化可知,被氧化的氯化氢占参加反应氯化氢的一半。
MnCl2+Cl2↑+2H2O的反应中,氯元素失去2个电子,锰元素得到2个电子;(2)根据化合价变化,判断氧化剂、还原剂、被氧化的元素、被还原的元素;根据化合价变化可知,被氧化的氯化氢占参加反应氯化氢的一半。
解析:(1) ①2Al+Fe2O3![]() 2Fe+Al2O3的反应中,铝元素失去6个电子,铁元素得到6个电子,所以电子转移的方向和数目是
2Fe+Al2O3的反应中,铝元素失去6个电子,铁元素得到6个电子,所以电子转移的方向和数目是 ;
;
②MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O的反应中,氯元素失去2个电子,锰元素得到2个电子,所以电子转移的方向和数目是
MnCl2+Cl2↑+2H2O的反应中,氯元素失去2个电子,锰元素得到2个电子,所以电子转移的方向和数目是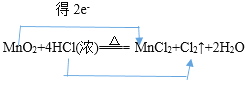 ;
;
(2)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O的反应中,二氧化锰中锰元素化合价由+4降低为+2,氯化氢中氯元素化合价由-1升高为0,所以在②中氧化剂是MnO2 ,还原剂是HCl,被氧化的元素是Cl,被还原的元素是Mn;根据化合价变化可知,被氧化的氯化氢占参加反应氯化氢的一半,氧化剂与还原剂之比是1:2,当有71gCl2生成时,被氧化的HCl的物质的量是2mol。
MnCl2+Cl2↑+2H2O的反应中,二氧化锰中锰元素化合价由+4降低为+2,氯化氢中氯元素化合价由-1升高为0,所以在②中氧化剂是MnO2 ,还原剂是HCl,被氧化的元素是Cl,被还原的元素是Mn;根据化合价变化可知,被氧化的氯化氢占参加反应氯化氢的一半,氧化剂与还原剂之比是1:2,当有71gCl2生成时,被氧化的HCl的物质的量是2mol。


科目:高中化学 来源: 题型:
【题目】CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。完成下列填空:

(1)用浓盐酸配制1:1(体积比)的稀盐酸(约6 mol·L-1),需要的玻璃仪器有___________
(2)上述装置中,A是___________溶液,其作用是___________ 。
(3)上述装置中,B物质是___________。
(4)一次性饭盒中石蜡和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
①从物质分类的角度分析,石蜡属于有机物中的____________类,为了将石蜡从饭盒中溶出,应选用下列试剂中的__________。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d 正已烷
②饭盒中的碳酸钙常用稀醋酸将其溶出,试写出其反应的离子方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3种物质①醋酸、②氧化铁、③氨气中,可用作红色颜料的是___________(填序号,下同),可用做制冷剂的是__________,可清除水壶中水垢的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列的措施中,不能使氢气生成速率加快的是 ( )
A. 加热 B. 不用稀硫酸,改用98﹪浓硫酸
C. 滴加少量硫酸铜溶液 D. 不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关石油和煤的叙述中,不正确的是
A. 煤的干馏属于化学变化
B. 石油分馏得到的汽油是混合物
C. 煤的气化和液化是物理变化
D. 石油裂化和裂解可以得到乙烯、丙烯等重要基本化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向Ba(OH)2溶液中滴加稀硫酸:OH-+H+==H2O
B. 向FeCl2溶液中通入氯气:Fe2++Cl2-=Fe3++2Cl-
C. 将NaHCO3溶液与H2SO4溶液混合:HCO3-+H+=H2O+CO2↑
D. 用醋酸除水垢:2H++Ca2++CO32-==Ca2++CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:P4(g)+6Cl2(g)![]() 4PCl3(g) ΔH=a kJ·mol1,
4PCl3(g) ΔH=a kJ·mol1,
P4(g)+10Cl2(g)![]() 4PCl5(g) ΔH =b kJ·mol1,
4PCl5(g) ΔH =b kJ·mol1,
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol1,PCl3中P—Cl键的键能为1.2c kJ·mol1。下列叙述正确的是
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)![]() PCl5(s)的反应热ΔH
PCl5(s)的反应热ΔH
C.Cl—Cl键的键能为(ba+5.6c)/4 kJ·mol1
D.P—P键的键能为(5a3b+12c)/8 kJ·mol1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com