
原子序数1—2的元素原子最外电子层上的电子数目从___________到___________;
原子序数3—10的元素原子最外电子层上的电子数目从___________到___________;
原子序数11—18的元素原子最外电子层上的电子数目从___________到___________。
运用以上的分析方法对1—18号元素的原子半径和化合价进行分析,我们可以发现,随着原子序数的递增,元素原子的最外层电子数、原子半径、元素的化合价等均呈现出___________的变化。在大量科学研究的基础上,人们归纳出这样一条规律:________________________,这个规律叫做元素周期律。元素周期律的实质是核外电子排布的___________变化。
 同步轻松练习系列答案
同步轻松练习系列答案科目:高中化学 来源: 题型:
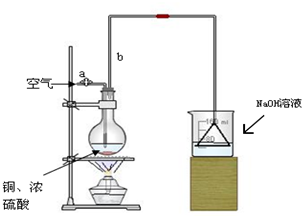 某学校课外活动小组针对教材中铜与浓硫酸反应,提出了“能够与铜反应的硫酸的最低浓度是多少?”的探究课题,并设计了如下方案进行实验:实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液.
某学校课外活动小组针对教材中铜与浓硫酸反应,提出了“能够与铜反应的硫酸的最低浓度是多少?”的探究课题,并设计了如下方案进行实验:实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com