
| A. | 等质量的NaHCO3和Na2CO3固体中,分别加入足量盐酸,NaHCO3产生的 气体多 | |
| B. | 过量的铁与硝酸反应生成硝酸亚铁,过量的铁与氯气反应也生成氯化亚铁 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水现酸性,向其中滴加几滴紫色石蕊试液,充分振荡后,溶液最终呈红色 |
分析 A.等质量的Na2CO3和NaHCO3固体,由n=$\frac{m}{M}$可知,NaHCO3的物质的量大;
B.过量的铁与氯气反应生成氯化铁;
C.一氧化氮易被氧气氧化为二氧化氮;
D.氯水中存在化学平衡,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白作用;
解答 解:A.等质量的Na2CO3和NaHCO3固体,由n=$\frac{m}{M}$可知,NaHCO3的物质的量大,与足量酸反应时,由C原子守恒可知,NaHCO3产生的CO2多,故A正确;
B.过量的铁与硝酸反应生成硝酸亚铁,氯气具有强氧化性,过量的铁在氯气中燃烧生成氯化铁,故B错误;
C.一氧化氮易被氧气氧化为二氧化氮,在空气中不能稳定存在,故C错误;
D.氯水中存在化学平衡,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白作用,向其中滴加几滴紫色石蕊试液,充分振荡后,溶液先变红色后褪色,故D错误;
故选A.
点评 本题考查学生物质的性质和用途等方面的知识,注意知识的归纳和整理是关键,难度不大.


科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ③④②①⑥⑤ | C. | ①④③②⑥⑤ | D. | ①③④②⑥⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9种 | B. | 10种 | C. | 12种 | D. | 15种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | B. | 气态氢化物稳定性为:ZH3>H2Y>HX | ||
| C. | 非金属性:X>Y>Z | D. | 原子半径:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精在实验台上燃烧时,用水扑灭火焰 | |
| B. | 给试管中的液体加热时,试管口不能对着别人 | |
| C. | 在烧杯中稀释浓硫酸时,应将水慢慢注入浓硫酸中,并用玻璃棒搅拌 | |
| D. | 不慎将浓硫酸沾到皮肤上,应用较多的水冲洗,然后涂上硼酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2,3,3-四甲基丁烷 | B. | 2,3,3,4-四甲基戊烷 | ||
| C. | 3,4-二甲基己烷 | D. | 2,5-二甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
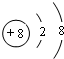 .
. 和XY2
和XY2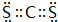 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com