

 2NO(g) ΔH
2NO(g) ΔH +180.5kJ/mol
+180.5kJ/mol  4NO(g) + 6H2O(g) ΔH
4NO(g) + 6H2O(g) ΔH ?905kJ/mol
?905kJ/mol 2H2O(g) ΔH
2H2O(g) ΔH ?483.6kJ/mol
?483.6kJ/mol ________________。
________________。 ,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________
,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________ (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。 2NH3(g),所以△H=(180.5kJ/mol×2+905kJ/mol-483.6kJ/mol×3)÷2=?92.4 kJ/mol。
2NH3(g),所以△H=(180.5kJ/mol×2+905kJ/mol-483.6kJ/mol×3)÷2=?92.4 kJ/mol。 2NH3(g)
2NH3(g)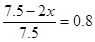
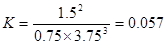 。
。 。如果盐酸的pH=14-a。则氨水过量,溶液显碱性。因此要使反应后溶液显中性,则盐酸的pH必须小于14-a。
。如果盐酸的pH=14-a。则氨水过量,溶液显碱性。因此要使反应后溶液显中性,则盐酸的pH必须小于14-a。

科目:高中化学 来源:不详 题型:单选题
| A.①②③④ | B.②③④ | C.①②③ | D.③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.工业上用NaOH溶液来去除MgCl2酸性溶液中的FeCl3 |
| B.氯气和氢气混合在光照条件下生成氯化氢,用水吸收得到盐酸 |
| C.采用高压条件,增大合成氨反应的化学平衡常数,增大原料转化率 |
| D.用Na2CO3溶液浸泡水垢,实现CaSO4向CaCO3的转化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④ | B.①②⑤⑦ | C.①⑧⑨ | D.①②⑥⑨ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 -锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
-锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。 -锂辉矿与硫酸等物质制备金属锂的工业流程如下图:
-锂辉矿与硫酸等物质制备金属锂的工业流程如下图:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.为了提高含氮量,可以不必考虑施用过程中化肥对土壤产生的不良影响 |
| B.碳铵化肥可以和碱性草木灰混合使用 |
| C.为增强作物的抗寒、抗旱能力,可以适当地施用一些磷肥 |
| D.使用了某一效果显著的杀虫剂后,可以不必更换品牌长期使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com