
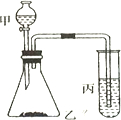
 比较硫、碳、硅的非金属性由强到弱的顺序,请从下列给出的试剂中选择合理的实验试剂,利用所给装置验证你的结论(提示:难溶于水).实验试剂:浓盐酸、稀H2SO4、饱和Na2SO3溶液、大理石、Na2CO3粉末、Na2SiO3溶液.实验装置:如图所示
比较硫、碳、硅的非金属性由强到弱的顺序,请从下列给出的试剂中选择合理的实验试剂,利用所给装置验证你的结论(提示:难溶于水).实验试剂:浓盐酸、稀H2SO4、饱和Na2SO3溶液、大理石、Na2CO3粉末、Na2SiO3溶液.实验装置:如图所示分析 比较碳、硅、硫的非金属性强弱,可根据对应的最高价氧化物的水化物的酸性强弱比较,可应用硫酸,用硫酸与碳酸盐反应制备二氧化碳,可证明非金属性S>C,二氧化碳气体通入硅酸钠溶液中,如生成硅酸沉淀,溶液变浑浊,可说明非金属性C>Si,注意制备二氧化碳,应用稀硫酸和碳酸钠反应,不能用大理石,以此解答该题.
解答 解:(1)根据原子结构特点:最外层电子数越多,元素的非金属性越强,最外层电子数一样,半径越小,非金属性越强,故硫、碳、硅的非金属性由强到弱的顺序为硫>碳>硅,故答案为:硫>碳>硅;
(2)甲盛装液体,应为稀硫酸,甲乙反应用来制备二氧化碳,则乙中应为Na2CO3粉末,注意不能用大理石,因硫酸与大理石反应生成硫酸钙微溶于水,阻碍反应继续进行,丙中盛Na2SiO3溶液,如溶液变浑浊,可说明非金属性C>Si,故答案为:稀硫酸;Na2CO3粉末;Na2SiO3溶液;
(3)硫酸和碳酸钠反应生成二氧化碳和水,反应的离子方程式为CO32-+2H+=CO2↑+H2O,现象是产生无色的气体,生成的二氧化碳通入丙中,和硅酸钠反应生成硅酸沉淀,可观察到丙中有白色胶状沉淀产生,
故答案为:产生无色的气体;有白色胶状沉淀产生;
(4)元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,由实验可知碳、硅、硫的非金属性由强到弱的顺序为S>C>Si,最高价含氧酸的酸性从强到弱的顺序:H2SO4>H2CO3>H2SiO3;故答案为:H2SO4>H2CO3>H2SiO3.
点评 本题考查了元素非金属性强弱的比较,为高频考点,侧重于考查学生的实验探究能力,注意把握实验的原理和实验方法,题目难度中等.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:H2O>H2S | B. | 原子半径:Na>Mg | ||
| C. | 酸性:H3PO4>H2SO4 | D. | 还原性:I->Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:| 编号 | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶解 的时间/s |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | t1 |
| E | 2 | 细小颗粒 | 15 | t2 |
| F | 2 | 粉末 | 15 | t3 |
| G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3过量 | |
| B. | AlCl3的量恰好与氢氧化钠完全反应 | |
| C. | 两种碱均过量 | |
| D. | AlCl3的量恰好与氨水完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是吸热反应都需要加热 | |
| B. | 物质的化学变化都伴随着能量变化 | |
| C. | 表示中和热的热化学方程式:NaOH+HCl═NaCl+H2O△H=-57.3 kJ•mol-1 | |
| D. | 等质量的硫蒸气和硫固体分别完全燃烧,前者的反应热比后者大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b-a-4 | B. | b-a-8 | C. | b+a+8 | D. | b-a-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$ NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| B. | Mg3N2$\stackrel{H_{2}O}{→}$Mg(OH)2$\stackrel{△}{→}$MgO | |
| C. | Mg$→_{加热}^{SO_{2}}$MgO | |
| D. | MgCl2(aq)$\stackrel{蒸发浓缩}{→}$MgCl2•6H2O$\stackrel{熔融电解}{→}$Mg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com