
【题目】下列热化学方程式及有关应用的叙述中,正确的是( )
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+![]() O2(g)═CO(g)+2H2O(l) △H=-890.3kJmol-1
O2(g)═CO(g)+2H2O(l) △H=-890.3kJmol-1
B.已知强酸与强碱在稀溶液里反应的中和热为57.3kJmol-1,则![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+ H2O(l) △H<-57.3kJmol-1
BaSO4(s)+ H2O(l) △H<-57.3kJmol-1
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJmol-1
2NH3(g) △H=-38.6kJmol-1
D.已知25℃、101KPa条件下:4Al(s)+3O2(g)═2A12O3(s)△H=-2834.9kJmol-1,4Al(s)+2O3(g)═2A12O3(s) △H=-3119.1kJmol-1,则O3比O2稳定
【答案】B
【解析】
A. 甲烷的燃烧热是指甲烷完全燃烧生成稳定的产物时放出的热量,而反应的产物为CO,则△H>-890.3kJmol-1,A错误;
B. 反应![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+ H2O(l),既包含H+(aq)+OH-(aq)=H2O(l),又包含
BaSO4(s)+ H2O(l),既包含H+(aq)+OH-(aq)=H2O(l),又包含![]() SO42-(aq)+
SO42-(aq)+![]() Ba2+(aq)═
Ba2+(aq)═![]() BaSO4(s),所以△H为两反应之和,故△H<-57.3kJmol-1,B正确;
BaSO4(s),所以△H为两反应之和,故△H<-57.3kJmol-1,B正确;
C. N2与H2的反应可逆,0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H<-38.6kJmol-1,C错误;
2NH3(g) △H<-38.6kJmol-1,C错误;
D. 4Al(s)+3O2(g)═2A12O3(s)△H=-2834.9kJmol-1,4Al(s)+2O3(g)═2A12O3(s) △H=-3119.1kJmol-1,表明O3比O2能量高,稳定性差,D错误。
故选B。


科目:高中化学 来源: 题型:
【题目】(1)298K时,将20mL3xmol·L-1Na3AsO3、20mL3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO![]() (aq)+I2(aq)+2OH-(aq)
(aq)+I2(aq)+2OH-(aq)![]() AsO
AsO![]() (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
(aq)+2I-(aq)+H2O(l)。溶液中c(AsO![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
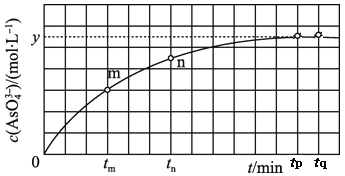
①下列可判断反应达到平衡的是__(填标号)。
a.溶液的pH不再变化
b.v(I-)=2v(AsO![]() )
)
c.![]() 不再变化
不再变化
d.c(I-)=ymol·L-1
e.![]() =
=![]() 不再变化
不再变化
②tn时,v正__v逆(填“大于”“小于”或“等于”)。
③tm时v逆__tn时v逆(填“大于”“小于”或“等于”),理由是__。
④比较产物AsO![]() 在tm~tnmin和tp~tqmin时平均反应速率的大小,前者__;(填大或小或相等)
在tm~tnmin和tp~tqmin时平均反应速率的大小,前者__;(填大或小或相等)
(2)合成氨工厂常通过测定反应前后混合气体的密度来确定氨的转化率。某工厂测得合成塔中N2、H2混合气体的密度为0.5536g/L(标准状况),从合成塔中出来的混合气体在相同条件下密度为0.693g/L(标准状况)。该合成氨厂N2的转化率___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子的性质的解释中,不正确的是
A.CH≡C-CH=CH-CH3 中σ键和π键数目之比为 10:3
B.![]() 分子中不含手性碳原子
分子中不含手性碳原子
C.硫难溶于水,微溶于酒精,易溶于 CS2,说明极性:水>酒精>CS2
D.由 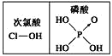 知酸性:H3PO4>HClO
知酸性:H3PO4>HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物。1,4-二氧杂螺[2.2]丙烷的结构简式为![]() 。下列说法正确的是
。下列说法正确的是
A. 1mol该有机物完全燃烧需要4molO2
B. 该有机物与 HCOOCH=CH2互为同分异构体
C. 该有机物的二氯代物有3种
D. 该有机物所有原子均处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置中,A是氯气发生仪器,C、D为气体净化装置(C中装有饱和食盐水.D中装有浓硫酸),E是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G中装有氢氧化钠溶液。请回答下列问题:
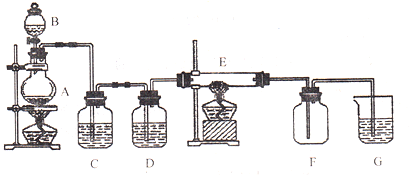
(1)仪器A的名称是______________;
(2)请完成实验室制氯气的化学方程式:![]() ________
________![]()
(3)C装置的作用是_____________________;D装置的作用是_____________________;
(4)E中发生化学反应的方程式为:_________________________________________;
(5)烧杯G中发生反应的化学方程式为:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氨基甲酸置于恒容的密闭真空容器中(固体体积忽略不计),使其达到化学平衡:H2NCOONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
下列有关叙述正确的是
A. 在低温下该反应能自发进行
B. 15℃时,该反应的化学平衡常数约为2.0
C. 当混合气体平均相对分子质量不变时,该反应达到化学反应限度
D. 恒温条件下,向原平衡体系中再充入2molNH3和1molCO2,达平衡后CO2浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“软电池”采用一张薄层纸片作为传导体,一面镀Zn,另一面镀MnO2。电池总反应为Zn+2MnO2+H2O=2MnO(OH)+ZnO。下列说法正确的是( )
A.该电池的正极为ZnO
B.Zn电极附近溶液的pH不变
C.电池正极的电极反应为2MnO2+2e-+2H2O=2MnO(OH)+2OH-
D.当0.1molZn完全溶解时,流经电解液的电子的物质的量为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应A+2B![]() 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断( )
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断( )
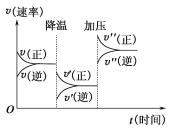
A.温度越高,该反应的化学平衡常数越大B.若A、B是气体,则D是液体或固体
C.逆反应是放热反应D.A、B、C、D均为气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com