
| A、锿 At | B、铯 Ce | C、硒 Se | D、锑 Ti |
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
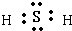
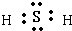
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省晋江市季延中学高二上学期期末考试化学试卷 题型:填空题
(10分)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 基态原子核外电子共占据5个原子轨道且有2个未成对电子, |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| | A-B | A=B | A≡B |
| CO | 357.7 | 798.9 | 1071.9 |
| Y2 | 154.8 | 418.4 | 941.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列条件写出元素名称和元素符号,并画出原子结构示意图,把结果填在表中。
(1)、A元素原子核外M层电子数是L层电子数的1/2
(2)、B元素原子的最外层电子数是次外层电子数的1.5倍。
(3)、C元素原子的L层电子数与K层电子数之差是电子层数的2.5倍。
(4)、D元素原子的次外层电子数是最外层电子数的1/4。
| 编号 | A | B | C | D |
| 元素符号 | ||||
| 元素名称 | ||||
| 原子结构 示意图 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com