
 减少二氧化碳的排放以及资源化利用具有重要意义.
减少二氧化碳的排放以及资源化利用具有重要意义.分析 (1)①6FeO(s)+CO2(g)═2Fe3O4(s)+C(s)△H=-76.0kJ•mol一1,
②C(s)+2H2O(g)═CO2(g)+2H2(g)△H=+113.4kJ•mol一1;
依据盖斯定律计算(①+②)×$\frac{1}{2}$得到反应的热化学方程式;
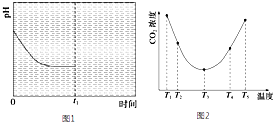
(2)①温度升高,c(CO2)增大,平衡逆向移动,说明反应Ⅲ是放热反应(△H<0);
②T1-T2区间,化学反应未达到平衡状态,温度越高,化学反应速率越快,所以CO2被捕获的量随着温度的升高而提高.T3-T4区间,化学反应已达到平衡状态,由于正反应为放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获
③反应Ⅲ在温度为T1时建立平衡后(由图2可知:溶液pH不随时间变化而变化),迅速上升到T2并维持温度不变,平衡逆向移动,溶液pH增大,在T2时又建立新的平衡;
(3)根据平衡移动原理分析;
解答 解:(1)①6FeO(s)+CO2(g)═2Fe3O4(s)+C(s)△H=-76.0kJ•mol一1,
②C(s)+2H2O(g)═CO2(g)+2H2(g)△H=+113.4kJ•mol一1;
依据盖斯定律计算(①+②)×$\frac{1}{2}$得到反应:3FeO(s)+H2O(g)═Fe3O4(s)+H2(g)的△H=+18.7 kJ•mol-1,
故答案为:+18.7 kJ•mol-1;
(2)①由图1可知:温度为T3时反应达平衡,此后温度升高,c(CO2)增大,平衡逆向移动,说明反应Ⅲ是放热反应△H<0,
故答案为:<;
②在T3前反应未建立平衡,无论在什么温度下(NH4)2CO3 (aq)总是捕获CO2,故c(CO2)减小,T1-T2区间,化学反应未达到平衡,温度越高,化学反应的速率越快,所以CO2被捕获的量随温度升高而提高.T4-T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获,
故答案为:T1-T2区间,化学反应未达到平衡,温度越高,化学反应的速率越快,所以CO2被捕获的量随温度升高而提高.T4-T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获;
③反应Ⅲ在温度为T1时建立平衡后(由图2可知:溶液pH不随时间变化而变化),迅速上升到T2并维持温度不变,平衡逆向移动,溶液pH增大,在T2时又建立新的平衡,图象应为,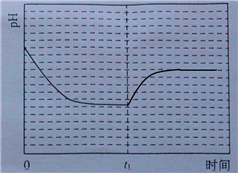 ;
;
故答案为:
(3)在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量,(NH4)2CO3(aq)+H2O(l)+CO2(g)?2(NH4)2HCO3(aq)△H<0,根据平衡移动原理,降低温度或增大c(CO2)(或分压),
故答案为:降低温度,增加CO2浓度(或分压);
点评 本题考查热化学方程式书写,化学反应速率、化学平衡移动和化学方程式书写等,题目综合性较强,难度中等.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:解答题
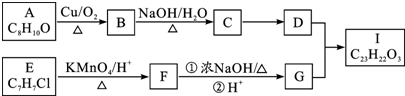
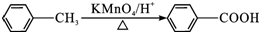
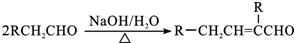
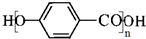
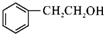 ,C→D的反应类型为加成反应,F中不含氧的官能团的名称为氯原子,I的结构简式为
,C→D的反应类型为加成反应,F中不含氧的官能团的名称为氯原子,I的结构简式为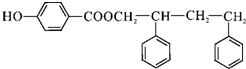 .
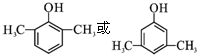
. ,F→G①的化学方程式为
,F→G①的化学方程式为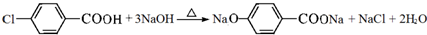 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将体积缩小为原来的一半,当体系再次达到平衡时,C02的浓度为原来的2倍 | |
| B. | CaCO3(s)加热分解生成Ca0(s)和C02,△s<0 | |
| C. | 将体积增大为原来的2倍,再次达到平衡时,气体密度不变 | |
| D. | 保持容器体积不变,充入He,平衡向逆反应方向进行. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 向澄清石灰水中通入少量CO2:OH-+CO2═HCO3- | |
| D. | 氯化亚铁溶液中通入氯气:Cl2+2Fe2+═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
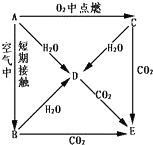 A、B、C、D、E五种物质都含钠元素,它们按图所示关系相互转化,已知A 为单质.
A、B、C、D、E五种物质都含钠元素,它们按图所示关系相互转化,已知A 为单质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内2amol A生成,同时生成3amol B | |
| B. | A、B、C的浓度不再变化 | |
| C. | 混合气体的总压强不再变化 | |
| D. | A、B、C的分子数目比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 处理过程中银器一直保持恒重 | |
| B. | 银器为正极,Ag2S被氧化生成单质银 | |
| C. | 该过程中总反应为2Al+3Ag2S═6Ag+Al2S3 | |
| D. | 黑色褪去的原因是黑色Ag2S转化为白色Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液与足量氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 用醋酸除水垢:2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2↑ | |
| C. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| D. | SO2通入碘水中,反应的离子方程式为:SO2+I2+2H2O═SO32-+2I-+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com