
前四周期主族非金属元素X、Y、Z和W在元素周期表中的相应位置如图所示。下列说法正确的是( )
| X | Y | |
| Z | W |
A.元素X和元素W最高正价代数和一定为8
B.若元素X的原子序数为a,则Z的原子序数一定为a+9
C.常温下,若X的简单氢化物的水溶液能使红色石蕊试液变蓝,则元素Y的简单氢化物的沸点一定高于元素W的简单氢化物
D.原子半径的大小顺序为rW>rZ>rX>rY
科目:高中化学 来源: 题型:
铅蓄电池是典型的可充电电池,它的正负极极板是惰性材料,
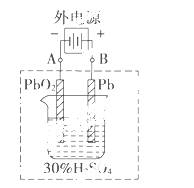
请回答下列问题(不考虑氢、氧的氧化还原):
(1)电解液中H2SO4的浓度将变______________________;
当外电路通过1 mol电子时,理论上负极板的质量增加__________g。
(2)在完全放电耗尽PbO2和Pb时,若按上图连接,电解一段时间后,则在A电极上生成________,B电极上生成____________,此时铅蓄电池的正负极的极性将________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g) ΔH1
C(s)+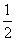 O2(g)===CO(g) ΔH2
O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3
S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+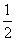 O2(g)===H2O(l) ΔH5
O2(g)===H2O(l) ΔH5
2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7
CaO(s)+H2O(l)===Ca(OH2)(s) ΔH8
A.① B.④
C.②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列排序正确的是( )
A.酸性:H2CO3<C6H5OH<CH3COOH
B.碱性:Ba(OH)2<Ca(OH)2<KOH
C.熔点:MgBr2<SiCl4<BN D.沸点:PH3<NH3<H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
五种短周期元素A、B、C、D、E的原子序数依次增大。A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。
回答下列问题:
(1)五种元素中,原子半径最大的是_______,非金属性最强的是_______
(填元素符号)。
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是________(用化学式表示)。
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为________,其中存在的化学键类型为________。
(4)D最高价氧化物的水化物的化学式为________。
(5)单质D在充足的单质E中燃烧,反应的化学方程式为___________
_____________________________;D在不充足的E中燃烧,生成的主要产物的化学式为________________。
(6)单质E与水反应的离子方程式为______________________________
______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以NaBH4 (B元素的化合价为+3)和H2O2为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为MnO2,工作原理如图所示。下列说法不
正确的是( )
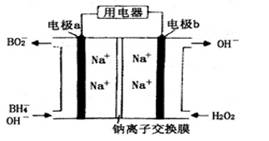
A.该电池工作时Na+由a极区移向b极区
B.电极b是原电池的正极
C.该电池的负极反应为:BH4—+8OH——8 e—= BO2—+6H2O
D.电路中通过6.02×1022个电子时,理论上消耗H2O20.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某食用白醋是由醋酸与纯水配制而成,用0.1000 mol/L NaOH溶液准确测定其中醋酸的物质的量浓度。以下为某同学列出的实验步骤(未排序),请回答下列问题。
A.分别向碱式滴定管、酸式滴定管注入NaOH标准溶液和待测醋酸至0刻度以上2~3cm
B.调节滴定管液面至0或0刻度以下,记下读数
C.用NaOH标准溶液滴定至终点,记下滴定管液面的刻度
D.用标准液清洗碱式滴定管2~3次;待测醋酸清洗酸式滴定管2~3次
E.用待测醋酸清洗锥形瓶2~3次
F.排气泡使滴定管尖嘴充满溶液,把滴定管固定好
G.滴定管检漏,用水清洗所有仪器,备用
H.通过酸式滴定管向锥形瓶注入20.00 mL待测醋酸,并加入2-3滴指示剂
(1)用离子方程式表示该实验的原理 。
(2)从上述实验步骤中选出正确的并按操作先后排序。你的实验顺序为:(用字母表
示) 。
(3)实验室常用的酸碱指示剂有甲基橙、石蕊和酚酞,你选择的指示剂是________,滴定
终点的现象是_________________________________。
(4)某同学实验后得到的数据如下:
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 | 5 |
| V(NaOH) /mL(初读数) | 0.00 | 0.20 | 0.00 | 0.10 | 0.05 |
| V(NaOH) /mL(终读数) | 15.75 | 15.20 | 14.98 | 15.12 | 15.05 |
原白醋中醋酸的物质的量浓度为________mol/L(结果保留4位有效数字)。
(5)分析下列操作对测定结果的影响,用“偏低”、“偏高”或“不影响”填空。
①滴定前碱式滴定管充满溶液,滴定后尖嘴处有气泡_______;
②读取标准溶液体积时,滴定前平视,滴定后仰视________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铜锌原电池(如下图)工作时,下列叙述正确的是( )

A.正极反应为:Zn-2e-===Zn2+
B.电池反应为:Zn+Cu2+===Zn2++Cu
C.在外电路中,电子从负极流向正极
D.盐桥中的K+移向ZnSO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com