
| A、0.1mol/LNa2S2O3和H2SO4各5mL,加水5mL,反应温度10℃ |
| B、0.1mol/LNa2S2O3和H2SO4各5mL,加水10mL,反应温度10℃ |
| C、0.1mol/LNa2S2O3和H2SO4各5mL,加水5mL,反应温度30℃ |
| D、0.1mol/LNa2S2O3和H2SO4各5mL,加水10mL,反应温度30℃ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 分类 组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | 纯碱 | 盐酸 | 烧碱 | 氧化铝 | 二氧化碳 |
| B | 烧碱 | 硫酸 | 食盐 | 氧化镁 | 一氧化碳 |
| C | 苛性钠 | 醋酸 | 碳酸铵 | 过氧化钠 | 二氧化硫 |
| D | 苛性钾 | 油酸 | 小苏打 | 氧化钠 | 三氧化硫 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到沉淀.
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到沉淀.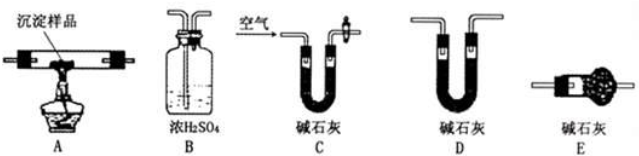
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B、沉淀溶解后,将生成深蓝色的配离子[Cu(NH3)4]2+ |
| C、向反应后的溶液加入乙醇,溶液将会没有发生任何变化,因[Cu(NH3)4]2+不会与乙醇发生反应 |
| D、在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 molA+1 molB |
| B、2 molA+1 molB+3 molC+1 molD |
| C、3 molC+1 molD |
| D、3 molC+1 molD+1 molB |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三者对应的氧化物中,氧化铝为两性氧化物,其它的均为碱性氧化物 |
| B、电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
| C、制备AlCl3、FeCl3、CuCl2均不能采用将其溶液直接蒸干的方法 |
| D、配制AlCl3、FeCl3、CuCl2溶液时均需加盐酸抑制水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com