
| 物质 | 试剂 | 分离方法 | |
| ① | 乙烷(乙烯) | H2 | 催化剂加热 |
| ② | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
| ③ | 乙醇(水) | 生石灰 | 蒸馏 |
| ④ | 苯(苯酚) | 浓溴水 | 分液 |
| A. | ①② | B. | ①③ | C. | ③④ | D. | 只有③ |
分析 ①乙烯与氢气发生加成反应,但乙烷中易引入新杂质氢气;
②乙酸与碳酸钠反应后,与乙酸乙酯分层;
③CaO与水反应后,增大与乙醇的沸点差异;
④溴、三溴苯酚均易溶于苯.
解答 解:①乙烯与氢气发生加成反应,但乙烷中易引入新杂质氢气,应选溴水、洗气分离,故错误;
②乙酸与碳酸钠反应后,与乙酸乙酯分层,然后分液分离,故错误;
③CaO与水反应后,增大与乙醇的沸点差异,然后蒸馏分离,故正确;
④溴、三溴苯酚均易溶于苯,引入新杂质,应选NaOH溶液、分液,故错误;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应、分离方法选择为解答的关键,侧重分析与实验能力的考查,注意有机物性质的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | W1>W2>W3 | B. | W1=W2=W3 | C. | W3>W1>W2 | D. | W3>W2>W1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
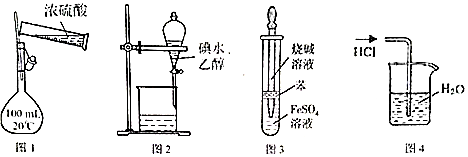
| A. | 用图1装置配制100 mL 0.1mol•L-1硫酸 | |
| B. | 用图2所示装置可萃取碘水中的碘 | |
| C. | 用图3所示装置可制备氢氧化亚铁 | |
| D. | 用图4所示装置可吸收HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中一定有元素化合价的升降 | |
| B. | 离子化合物这一定含有金属元素 | |
| C. | 置换反应一定是金属单质与盐酸类之间的反应 | |
| D. | 在常温和101kPa,1mol任何气体的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉不需要密封保存 | |
| B. | FeCl2溶液保存时加入少量铁粉 | |
| C. | 镁条应保存在煤油中 | |
| D. | NaOH溶液应保存在配有玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
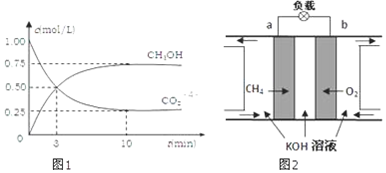
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13g 和 和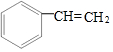 的混合物中含有的电子数为7NA 的混合物中含有的电子数为7NA | |
| B. | 60gSiO2中含有的共价键数目为4NA | |
| C. | 标准状况下,11.2LH2和Cl2反应后得到的气体中含有的原子总数为NA | |
| D. | 1molNaCO3溶于水后,所得溶液中CO32-和HCO3-的总数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com