
分析 (1)需要1mol•L-1NaOH溶液450mL,应选择500mL容量瓶,实际得配制500mL,依据m=CVM计算需要溶质的质量;分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(2)依据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释规律计算需要浓硫酸体积,据此选择量筒规格;依据配制一定物质的量浓度溶液一般步骤选择需要仪器;
解答 解:(1)需要1mol•L-1NaOH溶液450mL,应选择500mL容量瓶,实际得配制500mL,则需要溶质的质量m=1mol/L×40g/mol×0.5L=20.0g;
在实验中其他操作均正确,若定容时仰视刻度线,导致溶液的体积偏大,溶液浓度浓度偏小;
故答案为:20.0;小于;
(2)98%(密度为1.84g/mL)浓硫酸的物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=1mol/L×100mL,解得V=5.4mL,应选择10mL量筒量取;
配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀,用到的仪器:
量筒、胶头滴管、50mL烧杯、玻璃棒、100mL容量瓶,故选A;
故答案为:5.4;A.
点评 本题考查了一定物质的量浓度溶液的配制及有关物质的量浓度计算,明确配制原理和操作步骤是解题关键,题目难度不大.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
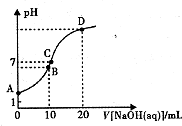 常温下,用0.1 mol/LNaOH溶液滴定10mL 0.1mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法不正确的是( )
常温下,用0.1 mol/LNaOH溶液滴定10mL 0.1mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法不正确的是( )| A. | A点溶液中加入少量水:$\frac{c(O{H}^{-})}{c({H}_{2}A)}$增大 | |
| B. | B点:c( HA -)>c(H+)>c(A2一)>c(H2A) | |
| C. | C点:c(Na+)=c(HA-)+2c( A2-) | |
| D. | 水电离出来的c(OH-):B点>D点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液滴加NaHSO4溶液至沉淀恰好完全:Ba 2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 用Pt 电极电解MgCl2溶液 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 往漂白粉溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| D. | 苯酚钠溶液与氯化铝溶液反应 3C6H5O-+Al3++3H2O═3C6H5OH+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
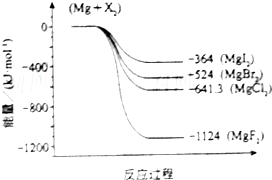 镁化合物和氯气均具有广泛用途,请回答下列问题:
镁化合物和氯气均具有广泛用途,请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L SO3中含有的分子数为NA个 | |
| B. | 标准状况下,2.24 L NH3和CH4的混合气体,所含电子总数为2NA | |
| C. | 7.1 g Cl2与足量的铁反应转移的电子数目是0.3NA | |
| D. | 1 mol C5H12分子中共价键总数为16NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com