
现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如下:

有关说法错误的是( )
A.反应Ⅰ原理为CO2 + NH3 + NaCl + H2O == NaHCO3↓ + NH4Cl
B.向饱和NaCl溶液中先通入足量的CO2,再通入足量的NH3
C.反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱
D.往母液中通入氨气,加入细小的食盐颗粒并降温,可使氯化铵析出
B
【解析】
试题分析:A、在氨气饱和的氯化钠溶液中通入CO2气体生成碳酸氢钠晶体和氯化铵,即CO2 + NH3 + NaCl + H2O == NaHCO3↓ + NH4Cl,A正确;B、CO2在水中的溶解度小,所以要先通入氨气,后通入CO2,B错误;C、碳酸氢钠受热分解生成碳酸钠、水和CO2,C正确;D、根据NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓及流程图知,母液中溶质为氯化铵,向母液中通氨气加入细小食盐颗粒,冷却析出副产品,通入的氨气和水反应生成一水合氨,一水合氨电离出铵根离子,铵根离子浓度增大有利于析出氯化铵,D正确,答案选B。
考点:考查侯氏制碱法的有关判断


科目:高中化学 来源:2015届浙江省协作体高三第一次适应性测试理科综合化学卷(解析版) 题型:填空题
(14分)已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
请回答下列问题:
(1)该反应平衡常数表达式为K=______ ;ΔH___0(选填“>”、“<”或“=”)。
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,若测得反应初始至6 S内A的平均反应速率v(A)=0.003 mol · L-1· S-1,则6 S时c(A)=______ mol·L-1;C的物质的量为______ mol 。
(3)在与(2)相同的温度、容器及A、B配比下反应经一段时间后达到平衡,此时A的转化率为______;如果这时向该密闭容器中再充入1 mol氩气,则平衡时A的转化率______ (选填“增大”、“减小”、“不变”)。
(4)判断该反应是否达到平衡的依据为______(填正确选项的字母)。
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(5)1200 ℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为______ 。
A(g)+B(g)的平衡常数的值为______ 。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三第一次联考化学试卷(解析版) 题型:选择题
某固体粉末甲中可能含有K2CO3、KNO3、NaNO2、K2SO3、Na2SO4、FeO、Fe2O3中的若干种,某同学为确定该固体粉末的成分,取甲进行连续实验,实验过程及现象如下 ( )
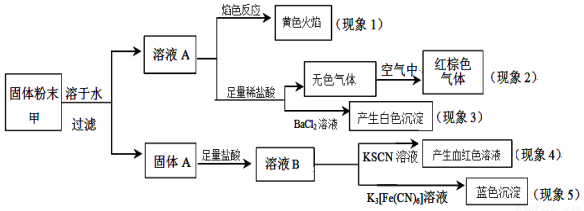
该同学得出的结论正确的是
A.根据现象1可推出该固体粉末中含有钠元素,但不含钾元素
B.根据现象2可推出该固体粉末中一定含有NaNO2
C.根据现象3可推出该固体粉末中一定含有Na2SO4
D.根据现象4和现象5可推出该固体粉末中一定含有FeO和Fe2O3
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三第一次联考化学试卷(解析版) 题型:选择题
奥运会会标是五环旗,假定奥运五环旗中的一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应,且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是 ( )
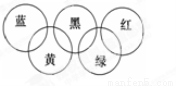
| 蓝 | 黄 | 黑 | 绿 | 红 |
A | SiO2 | NaOH溶液 | CuSO4溶液 | Ag | O2 |
B | O2 | Fe | 稀H2SO4 | NaOH溶液 | CO2 |
C | O2 | NH3 | 稀H2SO4 | NaOH溶液 | Al(OH)3 |
D | Mg | Al | CO2 | Fe2O3 | KOH溶液 |
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三上学期期中联考化学试卷(解析版) 题型:选择题
25℃时,已知弱酸的电离常数:K(CH3COOH) = 1.8 ×10-5;K1(H2CO3) = 4.4 ×10-7;K2(H2CO3) = 4.7 × 10-11;K(HClO) = 4.0 ×10-8。则下列说法正确的是( )
A.25℃时,0.1mol/L的醋酸溶液比0.01mol/L的醋酸溶液的K值小
B.25℃时,甲基橙滴入0.1mol/L的醋酸溶液中,溶液呈黄色
C.新制氯水与碳酸氢钠不反应
D.等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pH:
pH(Na2CO3)>pH(NaClO)>pH(CH3COONa)
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三上学期期中联考化学试卷(解析版) 题型:选择题
下列离子方程式错误的是( )
A.向Mg(HCO3)2溶液中加入过量的 NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
B.向亚硫酸钡固体中加入稀硝酸:3BaSO3+2H++2NO3-=3BaSO4↓+2NO↑+H2O
C.在银氨溶液中滴加过量稀硝酸:[Ag(NH3)2]+ +2H+ = Ag++2NH4+
D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:
Ba2+ + 2OH- + NH4+ + H+ + SO4 2- = BaSO4↓+ NH3·H2O + H2O
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三9月月考化学试卷(解析版) 题型:实验题
(10分)欲用98%的浓硫酸(ρ=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL。
(1)选用的主要仪器有:量筒,烧杯,玻璃棒,胶头滴管,________。
(2)现有下列配制操作:
A 用量筒量取浓H2SO4 B 反复颠倒摇匀 C 用胶头滴管加水至刻度
D 洗净并干燥所用仪器 E.稀释浓H2SO4 F.将溶液转入容量瓶
其正确的操作顺序为:___________ 。
(3)简要回答下列问题:
①所需浓硫酸的体积为_______mL。
②如果实验室有15mL 、20mL、 50mL的量筒,应选用 _____mL的量筒最好,量取时发现量筒不干净,用水洗净后直接量取将使配制的浓度_____________(偏高、偏低、无影响)。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三9月月考化学试卷(解析版) 题型:选择题
下列叙述中,正确的是( )
A.含最高价元素的化合物,一定具有强氧化性
B.阳离子只有氧化性,阴离子只有还原性
C.失电子越多,还原能力越强
D.强氧化剂与强还原剂不一定能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2015届浙江省杭州市高三10月月考化学试卷(解析版) 题型:填空题
(3分)在三种无机钠盐的透明溶液中分别加入稀盐酸时都能产生沉淀,其中酸过量时沉淀溶解的是_________,沉淀不溶解的是________或________。(填写化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com