
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | | FeBr2 | / | | Cl- |
| ② | MnO2 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
 MnCl2+Cl2↑+2H2O;氧化性MnO2> Cl2;2Fe2++Cl2= 2Cl-+2Fe3+;氧化性 Cl2>Fe3+;发生反应Cl2+2NaBr=2NaCl+Br2 ,氧化性Cl2>Br2,发生反应:2Fe2++Br2= 2Br-+2Fe3+ 氧化性Br2> Fe3+;错误。C.表中②组反应MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;氧化性MnO2> Cl2;2Fe2++Cl2= 2Cl-+2Fe3+;氧化性 Cl2>Fe3+;发生反应Cl2+2NaBr=2NaCl+Br2 ,氧化性Cl2>Br2,发生反应:2Fe2++Br2= 2Br-+2Fe3+ 氧化性Br2> Fe3+;错误。C.表中②组反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O的氧化产物是Cl2,1molMnO2电子转移数目是2NA。错误。D.表中③组反应的离子方程式为:2MnO4—+5H2O2+ 6H+= 2Mn2++5O2↑+8H2O.电子不守恒.错误.
MnCl2+Cl2↑+2H2O的氧化产物是Cl2,1molMnO2电子转移数目是2NA。错误。D.表中③组反应的离子方程式为:2MnO4—+5H2O2+ 6H+= 2Mn2++5O2↑+8H2O.电子不守恒.错误.

科目:高中化学 来源:不详 题型:单选题
| | A | B | C | D |
| 装 置 |  | 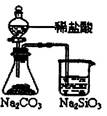 |  |  |
| 结 论 | 实验室制取乙炔 | 能证明非金属性 Cl>C>Si | 分离出Cl2与KI溶 液反应生成的碘 | 白色沉淀是BaSO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.只有⑤ | C.①②③④⑤ | D.①② |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Sn2+、Fe2+、Ce3+ | B.Sn2+、Ce3+、Fe2+ |
| C.Ce3+、Fe2+、Sn2+ | D.Fe2+、Sn2+、Ce3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.滴加KI溶液时,转移2 mol e一时生成1 mol白色沉淀 |
| B.通入S02后溶液逐渐变成无色,体现了S02的漂白性 |
| C.通入S02时,S02与I2反应,I2作还原剂 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>S02 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
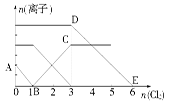
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中c(FeBr2)=6 mol/L |
| C.当通入Cl2 2 mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.M为H2O |
| B.每还原1 mol氧化剂,就有3 mol电子转移 |
| C.还原性:SnCl2>As |
| D.氧化产物和还原产物的物质的量之比为2∶3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com