
| A. | 需要加快反应速率的过程是炼钢 | |
| B. | 世界上第一张元素周期表的作者是门捷列夫 | |
| C. | 乙烯与溴的四氯化碳溶液反应的类型为取代反应 | |
| D. | 在葡萄糖溶液中加入新制的Cu(OH)2,加热煮沸后产生沉淀的颜色为砖红色 |
分析 A.为提高生产效益或促进人类发展的反应,需要加快反应速率;
B.1869年,俄国化学家门捷列夫发现了元素周期律;
C.乙烯与溴的四氯化碳溶液反应;
D.含醛基的物质能与新制的Cu(OH)2,加热煮沸后产生氧化亚铜沉淀.
解答 解:A.工业炼钢为有利于人类发展的反应,需要加快反应速率,故A错误;
B.俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,故B正确;
C.乙烯与溴的四氯化碳溶液反应,乙烯中C=C双键断裂,不饱和碳原子结合溴原子生成1,2-二溴乙烷,属于加成反应,故C正确;
D.葡萄糖含醛基,含醛基的物质能与新制的Cu(OH)2,加热煮沸后产生砖红色氧化亚铜沉淀,故D正确.
故选A.
点评 本题考查化学反应速率、化学史、葡萄糖的性质和用途等性质,难度不大,注意掌握醛基的检验方法.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液呈酸性说明草酸是弱酸 | B. | c(K+)+c(H+)═c(HC2O4-)+c(OH-)+2c(C2O42-) | ||
| C. | c(K+)>c(HC2O4-)>c(C2O42-)>c(H+) | D. | c(H2C2O4)>c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 1-已醇的沸点比已烷的沸点高89℃ | 1-已醇和已烷可通过蒸馏初步分离 |
| B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
| C | H2SO4是离子化合物 | 硫酸溶液可导电 |
| D | 乙二酸可与KMnO4溶液发生反应 | 乙二酸具有酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
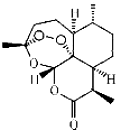 屠呦呦因发现和提取青蒿素在治疟疾方面的杰出贡献获得2015年诺贝尔生理学或医学奖.青蒿素分子式为C15H22O5,结构式如图.下列说法正确的是( )
屠呦呦因发现和提取青蒿素在治疟疾方面的杰出贡献获得2015年诺贝尔生理学或医学奖.青蒿素分子式为C15H22O5,结构式如图.下列说法正确的是( )| A. | 青蒿素是无机物 | |
| B. | 青蒿索的摩尔质量为282 | |
| C. | 屠呦呦发现用乙醚提取青蒿素效果很好,表明青蒿素难溶于水,易溶于乙醚,在水中溶解度不大 | |
| D. | 屠呦呦获得的是诺贝尔生理学或医学奖,说明无需学好化学,也能在医学上取得非凡的成绩 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl属于离子化合物 | B. | 原子团为OH-属于羟基 | ||
| C. | 乙醇与水混合后静置,不出现分层 | D. | 淀粉水解的最终产物含有葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
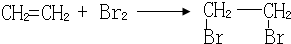 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
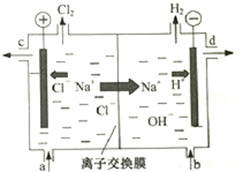 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.| K1 | K2 | |
| H2SO3 | 1.54x 10-2 | 1.02x 10-7 |
| HClO | 2.95x 10-8 | |
| H2CO3 | 4.3x 10-7 | 5.6x 10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属锗是一种良好的导热、导电材料 | |
| B. | 元素的非金属性越强,其氢化物的沸点越高 | |
| C. | 同周期相邻主族元素的原子,其质子数之差均为1 | |
| D. | 最外层电子数为4的原子,其元素一定处于ⅣA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com