
【题目】亚硫酸盐是一种常见食品添加剂.为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组用“碘氧化还原滴定法”进行测定,实验流程如图: 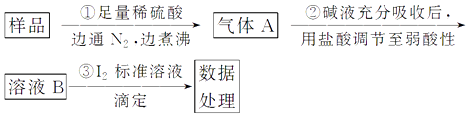
(1)碘标准液应选用(填“酸式”或“碱式”)滴定管盛装,加注标准液之前必须对滴定管进行、洗涤、润洗.
(2)锥形瓶内的指示剂为 , 判断达到滴定终点的依据 .
(3)下列操作会使测定结果偏大的有
A.起始读数时平视,终点读数时俯视
B.未用标准液润洗滴定管
C.步骤①中用稀盐酸代替稀硫酸
(4)若取样品wg,按乙方案测得消耗0.010molL﹣1I2溶液VmL,则1kg样品中含SO2的质量是g(用含w、V的代数式表示).
【答案】
(1)酸式;验漏(或查漏)
(2)淀粉溶液;溶液由无色变为浅蓝色,且半分钟不褪色
(3)B
(4)![]()
【解析】解:(1)碘标准液能腐蚀橡胶,不能用碱式滴定管,而用酸式滴定管.加注标准液之前必须对滴定管进行检漏,所以答案是:酸式;检漏;(2)亚硫酸盐或是亚硫酸氢盐与碘单质反应:HSO3﹣+I2+H2O=SO42﹣+2I﹣+3H+.碘遇淀粉变蓝色,用碘标准溶液滴定亚硫酸盐或是亚硫酸氢盐,可以使用淀粉溶液作指示剂,当蓝色消失时,反应恰好发生,即达到终点时的现象为:溶液由无色变为蓝色,且半分钟内不褪色.所以答案是:淀粉溶液;滴最后一滴时,溶液由无色变为浅蓝色,且半分钟不褪色;(3)A.起始读数时平视,终点读数时俯视,会造成V(标准)偏小,根据c(待测)= ![]() 分析,会造成c(待测)偏低,故A错误;
分析,会造成c(待测)偏低,故A错误;
B.未用标准液润洗滴定管.会造成V(标准)偏大,根据c(待测)= ![]() 分析,会造成c(待测)偏高,故B正确;
分析,会造成c(待测)偏高,故B正确;
C.步骤①中用稀盐酸代替稀硫酸.用盐酸代替硫酸,生成的SO2气体中混有少量HCl,因SO2用碱液吸收后需再用盐酸调节溶液至弱酸性,因此混合气体中含有HCl,对实验结果无影响.故C错误;(4)反应的离子方程式为H2O+SO32﹣+I2=SO42﹣+2H++2I﹣,
SO2~SO32﹣~ | I2 |
64g | 1mol |
m | 0.01000molL﹣1×V×10﹣3L=10﹣5mol |
m=64×V×10﹣5g,则1kg样品中含SO2的质量为 ![]() =
= ![]() ,
,
所以答案是: ![]() .
.


科目:高中化学 来源: 题型:
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾 (K2Cr2O7),其工艺流程及相关物质溶解度曲线如下图所示。

(1)向Na2Cr2O7母液中加碱液调pH的目的是_____________________。
(2)通过冷却结晶析出大量K2Cr2O7的原因是________________________________。
(3)固体A的主要成分为__________(填化学式),用热水洗涤固体A,回收的洗涤液转移到母液___________(填“I”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗降低。固体B的主要成分为___________________(填化学式)。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.500 g 配成250 mL溶液,用移液管取出25.00 mL于碘量瓶中,加入10 mL 2 mol·L-l H2SO4溶液和足量KI溶液(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL蒸馏水、3 mL 淀粉指示剂,用0.1200 mol·L-l Na2S2O3标准溶液滴定(已知I2+ 2S2O32-=2I-+S4O62-)。
①酸性溶液中KI 与K2Cr2O7反应的离子方程式为_____________________________。
②若实验中共用去Na2S2O3标准溶液40.00 mL,则所得产品中重铬酸钾的纯度为__________%( 保留2 位小数,设整个过程中其他杂质不参与反应)。进一步提纯产品的方法是___________________。
(5)+6价Cr的毒性很高,工业上用电解法来处理含Cr2O72-的废水。下图为电解装置示意图,电极材料分别为铁和石墨。通电后,Cr2O72-在b极附近转变为Cr3+,一段时间后Cr3+最终可在a 极附近变成Cr(OH)3沉淀而被除去。

①在以上处理过程中,Cr2O72-转化为毒性较低的Cr3+的离子方程式为________________________。
②a电极的电极反应式是是____________________;电解一段时间后在阴极区有Fe(OH)3和Gr(OH)3沉淀生成,若电解后的溶液中c(Cr3+)为3×10-5mol·L-1,则溶液中c(Fe3+)为____________ mol·L-1。已知:Ksp=[Fe(OH)3]=4.0×10-38,K[Cr(OH)3]=6.0×10-31。
【答案】 除去Fe3+ 低温下K2Cr2O7的溶解度远小于其他组分,且随温度的降低,K2Cr2O7的溶解度明显减小 NaCl Ⅱ K2Cr2O7 Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O 94.08 重结晶 Cr2O72-+6Fe2++ 14H+=2Cr3++6Fe3++7H2O 2H++2e-=H2↑ 2×10-12
【解析】考查化学工艺流程,(1)根据题目信息,母液中含有少量的Fe3+,加碱液的目的是除去Fe3+;(2)根据温度与溶解度的关系,K2Cr2O7的溶解度受温度的影响较大,低温时K2Cr2O7的溶解度远小于其他组分,且温度降低,K2Cr2O7的溶解度受温度的影响较大;(3)母液I中加入KCl,发生Na2Cr2O7+KCl=K2Cr2O7+NaCl,采用冷却降温得到K2Cr2O7固体,即母液II中含有大量的NaCl,因此蒸发浓缩得到的固体是NaCl;冷却结晶中有大量的K2Cr2O7析出,但溶液中含有少量的K2Cr2O7,蒸发浓缩时,NaCl表面附着一部分K2Cr2O7,为了提高产率又可使能耗降低,因此需要把洗涤液转移到母液II中,达到类似富集的目的;因此固体B的主要成分是K2Cr2O7;(4)①根据操作,得出K2Cr2O7 =2.352g,纯度为2.352/2.500×100%=94.08%;进一步提纯需要重新溶解,冷却结晶,此方法叫重结晶;(5)①b电极为阳极,应是失去电子,化合价应升高,而Cr2O72-中Cr的化合价降低,因此b电极为铁,此电极反应式为Fe-2e-=Fe2+,然后利用Cr2O72-的氧化性,与Fe2+发生反应,离子反应方程方式为Cr2O72-+6Fe2++ 14H+=2Cr3++6Fe3++7H2O;②根据①的分析,a电极为阴极,电极反应式为2H++2e-=H2↑;Cr3+和Fe3+共存在同一溶液中,因此有
=2.352g,纯度为2.352/2.500×100%=94.08%;进一步提纯需要重新溶解,冷却结晶,此方法叫重结晶;(5)①b电极为阳极,应是失去电子,化合价应升高,而Cr2O72-中Cr的化合价降低,因此b电极为铁,此电极反应式为Fe-2e-=Fe2+,然后利用Cr2O72-的氧化性,与Fe2+发生反应,离子反应方程方式为Cr2O72-+6Fe2++ 14H+=2Cr3++6Fe3++7H2O;②根据①的分析,a电极为阴极,电极反应式为2H++2e-=H2↑;Cr3+和Fe3+共存在同一溶液中,因此有 ,解得c(Fe3+)=2.0×10-12mol·L-1。
,解得c(Fe3+)=2.0×10-12mol·L-1。
点睛:氧化还原反应方程式的书写是学生的一个难点,学生往往找不出反应物或生成物,或者溶液的环境选错,这是对题的理解上不透彻,如本题的(5)①根据信息,Cr2O72-在b极附近转变为Cr3+,b极为阳极,阳极上失去电子化合价升高,而现在Cr的化合价降低,因此只能说明b极的材料是Fe,Fe-2e-=Fe2+,然后还原Cr2O7-,因此有Cr2O72-+Fe2+→Fe3++Cr3+,根据化合价升降法进行配平,即Cr2O72-+6Fe2+→2Cr3++6Fe3+,Fe2+、Fe3+、Cr3+不与OH-大量共存,因此溶液显酸性,根据反应前后所带电荷数守恒、原子守恒进行配平即可。
【题型】综合题
【结束】
10
【题目】“低碳经济”正成为科学家研究的主要课题,为了减少空气中的温室气体,并且充分利用二氧化碳资源,科学家们设想了一系列捕捉和封存二氧化碳的方法。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔH=-76.0 kJ·mol-1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1,则反应:3FeO(s)+ H2O(g)= Fe3O4(s)+ H2(g)的△H=__________。
(2)用氨水捕集烟气中的CO2生成铵盐是减少CO2排放的可行措施之一。
①分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图所示,若烟气中CO2的含量(体积分数)为12%,烟气通入氨水的流量为0.052 m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为____________(精确到0.01)。

②通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是______________。
(3)一定条件下,Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图所示。

①该反应的化学方程式为______________________;反应过程中碳元素的化合价为-2价的中间体是_________________。
②向一容积为2 L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2 mol·L-1、H2:0.8 mol·L-1、CH4:0.8 mol·L-1、H2O:1.6 mol·L-1,CO2的平衡转化率为_________________;300℃时上述反应的平衡常数K=___________________。
③已知该反应正反应放热,现有两个相同的恒容绝热(与外界无热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molCO2和4molH2,在Ⅱ中充入1molCH4和2molH2O(g),300℃下开始反应。达到平衡时,下列说法正确的是___________________(填字母)。
A.
B.容器Ⅰ、Ⅱ中CH4的物质的量分数相同
C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略)。

已知:①NaClO 在受热或酸性条件下易分解,3NaClO==2NaCl + NaClO3
②AgCl 可溶于氨水: AgCl+2NH3·H2O![]() Ag(NH3)2++Cl-+2H2O
Ag(NH3)2++Cl-+2H2O
③常温下,N2H4·H2O(水合肼)在碱性条件下能还原Ag(NH3)2+:
4 Ag(NH3)2++ N2H4·H2O ==4Ag↓+ N2 ↑+4NH4+ +4NH3 ↑+H2O
请回答下列问题:
(1)“氧化” 阶段需在80℃条件下进行,适宜的加热方式为____________________________。
(2)NaC1O溶液与Ag反应的产物为AgCl、NaOH 和O2,该反应的化学方程式为_____________。
(3)为提高AB的回收率,需对“过滤II”的滤渣进行洗涤,并_________________________。
(4)若省略“过滤I”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量次氯酸钠与氨水反应外(该条件下NaClO3 与氨水不反应),还因为___________________。
(5)利用题给信息,请设计从“过滤II”的滤液中获取单质Ag 的实验方案:____________(实验中须使用的试剂有: 2mol/L水合肼溶液,1mol/L H2SO4溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示.反应原理为:CH3CH2OH+O2═CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量.下列说法正确的是( ) 
A.b为正极,电极反应式为:O2+4H++4e﹣═2H2O
B.电解质溶液中的H+移向a电极
C.若有0.4 mol电子转移,则在标准状况下消耗4.48L氧气
D.呼出气体中酒精含量越高,微处理器中通过的电流越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使电解液复原的组合是( )
X | Y | Z | W | |
A | C | Fe | NaCl | H2O |
B | Pt | Cu | CuSO4 | CuSO4溶液 |
C | C | C | H2SO4 | H2O |
D | Ag | Fe | AgNO3 | AgNO3晶体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用氨水可以鉴别Al3+、Mg2+和Ag+
B. 用水鉴别乙醇、乙酸乙酯和溴苯
C. 除去乙酸乙酯中的乙酸:用NaOH溶液,然后分液
D. 除去乙烷中少量的乙烯:光照下通入Cl2,生成液态CH2Cl-CH2Cl,气液分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某运动员比赛后化验,体液中Ca2+含量太低,导致神经和肌肉的兴奋性过高而出现抽
搐。这一事实说明Ca2+的生物功能之一是 ( )
A. 构成细胞结构的主要成分之一 B. 维持细胞的正常形态
C. 维持细胞的正常生理功能 D. 调节渗透压和酸碱平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为前四周期元素,且原子序数依次增大。X基态原子的L层有3个单电子,Z是周期表中电负性最大的元素;Y与P为同主族元素,且P基态原子的M层电子数为K层的3倍;Q2+离子的3d轨道上有9个电子。回答下列问题。
(1)基态Y原子的价电子排布图是____;P所在周期中第一电离能最大的主族元素是__________ (元素名称)。
(2)XY3-中,中心原子的杂化方式为____________;XY2-离子的立体构型是_______________。
(3)X 的氢化物比Y的氢化物沸点低的原因是_________________________。
(4)X的氢化物易形成配位键,而XZ3不易形成配位键,原因是_____________________。
(5)Y 与Q所形成的化合物晶体晶胞如图所示,该晶体的化学式:______________;晶胞参数如图所示,则该晶胞密度是_______________g·cm-3。(列式并计算结果,保留小数点后一位)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是( )
A.K+的结构示意图: ![]()
B.B、基态氮原子的电子排布图 ![]()
C.水的电子式: ![]()
D.D、基态铬原子(24Cr)的价电子排布式:3d44s2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com