
����Ŀ��������������(��)�γɵ�һ�������[Co(NH3)5NO2]Cl2���Ʊ��������£�
CoCl2��6H2O![]() [Co(NH3)5Cl]Cl2
[Co(NH3)5Cl]Cl2![]() [Co(NH3)5NO2]Cl2
[Co(NH3)5NO2]Cl2
(1)Co2+��̬��������Ų�ʽΪ___��
(2)�����[Co(NH3)5Cl]Cl2����Co3+�γ���λ����ԭ��Ϊ___(��Ԫ�ط���)��������[Co(NH3)5NO2]2+�������е�ԭ�ӵ��ӻ��������Ϊ___��
(3)NO![]() �Ŀռ乹��Ϊ___��������Ϊ�ȵ�����ķ���Ϊ___(д��ѧʽ)��
�Ŀռ乹��Ϊ___��������Ϊ�ȵ�����ķ���Ϊ___(д��ѧʽ)��
(4)H2O2��H2O��������������ܣ�����Ϊ���Ƕ��Ǽ��Է����⣬����Ϊ___��
(5)1mol[Co(NH3)5Cl]Cl2�к�����������ĿΪ___��
���𰸡�1s22s22p63s23p63d7��[Ar]3d7 N��Cl sp3��sp2 V�� SO2��O3 H2O2��H2O���Ӽ���γ���� 21NA
��������
(1)��̬Coԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d74s2��[Ar]3d74s2��ʧȥ������������ӱ�ΪCo2+��
(2)�����[Co(NH3)5Cl]Cl2��Co3+�ṩ�չ����NH3�ĵ�ԭ����Cl-�ṩ�µ��Ӷ��γ���λ������������[Co(NH3)5NO2]2+������ΪNH3��NO2-�����ݼ۵��ӻ������۷����ж�Nԭ�ӵ��ӻ����ͣ�
(3)����(2)�з����ж�NO2-�Ŀռ乹�ͣ��������ԭ�����ͼ۵���������ȵ�����Ϊ�ȵ����壻
(4)H2O2��H2O֮����γ������
(5)[Co(NH3)5Cl]Cl2��[Co(NH3)5Cl]2+��Cl-���ɣ�1mol[Co(NH3)5Cl]Cl2�к���1mol[Co(NH3)5Cl]2+��Co3+�γ�������λ����ÿ��NH3�к���3�����۵��������۵�������λ������������
(1)��̬Coԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d74s2��[Ar]3d74s2��ʧȥ�������ӱ�ΪCo2+�����̬Co2+��������Ų�ʽΪ1s22s22p63s23p63d7��[Ar]3d7��
(2)�����[Co(NH3)5Cl]Cl2��Co3+�ṩ�չ����NH3�ĵ�ԭ����Cl-�ṩ�µ��Ӷ��γ���λ��������Co3+�γ���λ����ԭ��ΪN��Cl��������[Co(NH3)5NO2]2+������ΪNH3��NO2-��NH3�еĵ�ԭ�ӳɼ�����Ϊ3���µ��Ӷ���Ϊ1���۲���Ӷ���Ϊ4���õ�ԭ�ӵ��ӻ��������Ϊsp3��NO2-�еĵ�ԭ�ӳɼ�����Ϊ2���µ��Ӷ���Ϊ1���۲���Ӷ���Ϊ3���õ�ԭ�ӵ��ӻ��������Ϊsp2��
(3)����(2)�з���NO2-�ĵ�ԭ�ӵ��ӻ��������Ϊsp2���ռ乹��ΪV�Σ�NO2-��3��ԭ�ӹ��ɣ��۲��������Ϊ18��������Ϊ�ȵ�����ķ���ΪSO2��O3��
(4)H2O2��H2O��������������ܣ�����Ϊ���Ƕ��Ǽ��Է����⣬����ΪH2O2��H2O���Ӽ���γ������
(5)1mol[Co(NH3)5Cl]Cl2�к���1mol[Co(NH3)5Cl]2+��Co3+�γ�������λ����ÿ��NH3�к���3�����۵��������۵�������λ����������������������ĿΪ(6+5��3)��1��NA=21NA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ϊ36.2%�����ᣨ�ܶ�Ϊ1.16gcm-3������1.0molL-1��ϡ���ᡣ��ʵ������Ҫ����ϡ����220mL���Իش��������⣺
��1������ϡ����ʱ��Ӧѡ���ݻ�Ϊ___________mL������ƿ��
��2����������Ҫ___________mLŨ���ᣬ����ȡʱ��ѡ��������Ͳ�е�___________��
A.2mL B.10mL C.22mL D.20mL
��3������ȡŨ������������в�����
�ٴ�ϡ�͵�������¶�������һ�º��ز�����ע������ƿ�С�
��������ƿ��С�ļ�����ˮ��Һ��������ƿ�̶���12cmʱ�����ý�ͷ�ιܼ�����ˮ��ʹ��Һ��Һ����ƿ���Ŀ̶������С�
����ʢ������ձ���ע������ˮ�����ò�����������ʹ���Ͼ��ȡ�
��������ˮϴ���ձ��Ͳ�����2��3�Σ�����ϴ��Һȫ��ע������ƿ��
���������У���ȷ����˳���ǣ�����ţ�___________��
��4�����������ƹ����У��øո�ϴ�ӽྻ��������Ͳ����ȡŨ���ᣬ�����Ƶ�ϡ����Ũ��_______���ƫ�ߡ���ƫ�͡�����Ӱ�족����ͬ������δ������ˮϴ���ձ��ڱڻ�δ��ϴ��Һע������ƿ�����Ƶ�ϡ����Ũ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��WΪԭ������������������ֶ���������Ԫ�أ�A��B��C��D��EΪ��������Ԫ���е�һ�ֻ�������ɵ����ʡ���֪A�����к���18�����ӣ�C��D��Ư���ԡ��������ʼ��ת����ϵ��ͼ��ʾ������˵���������
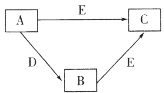
A.Y�ļ��⻯��ķе��Z�ĸ�
B.X��Y��ɵĻ������п��ܺ��зǼ��Լ�
C.Z���������Ӧˮ��������Ա�W����
D.W������������ԭ�Ӱ뾶��С��Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵������ȷ����( )
A. ���³�ѹ�£�56g��ϩ�뻷����Ļ�������к���4NA��̼ԭ��
B. 7.8g ���к��е�̼̼˫����ĿΪ0.3NA
C. ���³�ѹ�£�1.8g���������CD3���к��еĵ�����ΪNA
D. 10g��������Ϊ46%���Ҵ�ˮ��Һ���е���ԭ������Ϊ0.6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о������������������γ�����ʱ������еİ��й�(��ͼ��ʾ)�������йظ�Ԫ��ԭ�ӵ�˵����ȷ���ǣ� ��
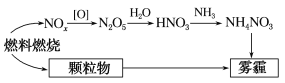
A.�ӽ��е��ˮ�����д������Ϸ����������Ϸ������ڴ������
B.��̬O2-�ļ۵����Ų�ʽΪ1s22s22p6
C.![]() ��N���ӻ���ʽΪsp3����SO3��Ϊ�ȵ�����
��N���ӻ���ʽΪsp3����SO3��Ϊ�ȵ�����
D.![]() �Ŀռ乹��Ϊ�������壬4��N-H���ۼ��ļ������
�Ŀռ乹��Ϊ�������壬4��N-H���ۼ��ļ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ס��顢����Ԫ�ؼ��仯�������ִ�ũҵ���Ƽ�����������������������ص���;��
(1)��̬��ԭ���к������ռ������ܲ�ķ���Ϊ__�����ܲ��ԭ�ӹ������__����
(2)����һ���⻯��N2H4��һ�����õĻ������ȼ�ϣ���ͳ�Ʊ��µķ����ǣ�NaClO+2NH3=N2H4+NaCl+H2O����֪�µ��۵㡢�е�ֱ�Ϊ1.4����113.5�����������۵㡢�е�ֱ�Ϊ-77.7����-33.5����
��N2H4�е�ԭ�ӵ��ӻ��������Ϊ__�ӻ�����̬Nԭ�ӵ���ռ������ܼ��ĵ���������ͼΪ___�Ρ�
�����백���۵㡢�е��������Ҫ��ԭ����__��
(3)��������һ�ֳ������壬������[Co(NH3)6]3+�д��ڵĻ�ѧ����__(�����)��
A.���Ӽ� B.���Լ� C.��λ�� D.���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������G��һ�ֿ���������������ҩ�ʵ�����ɷ�����A�Ʊ�G�ĺϳ�·�����£�
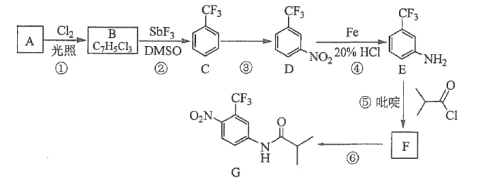
�ش��������⣺
��1��A�Ľṹ��ʽΪ______��B�Ĺ��������ƣ�_____��C�Ļ�ѧ������______��
��2���۵ķ�Ӧ�Լ��ͷ�Ӧ�����ֱ���_____���÷�Ӧ��������__________��
��3���ݵķ�Ӧ����ʽΪ____________��
��4��G�ķ���ʽΪ__________��
��5��H��G��ͬ���칹�壬�䱽���ϵ�ȡ������G����ͬ��λ�ò�ͬ����H���ܵĽṹ��______�֡�
��6��4-����������������![]() ������Ҫ�ľ�ϸ�����м��壬д���ɱ����ѣ�
������Ҫ�ľ�ϸ�����м��壬д���ɱ����ѣ�![]() ���Ʊ�4-���������������ĺϳ�·��_________�������Լ���ѡ����
���Ʊ�4-���������������ĺϳ�·��_________�������Լ���ѡ����
�ϳ�·��ʾ����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ�������
A. ���¡���ѹ�£�4.6 g NO2��N2O4��������к��е���ԭ����ĿΪ0.2NA
B. 1 mol���ǻ���1 mol������������������������Ϊ10NA
C. ��0.1 mol FeCl3����1 Lˮ�У�������Һ��Fe3��������ĿΪ0.1NA
D. �ڸ����£�1 mol Fe��������ˮ������Ӧ��ת�Ƶ��ӵ���ĿΪ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͼ�ĵ�ѭ������̬ϵͳ����ѭ������Ҫ���֣������Ӿ��˵�ѭ���е�����ת����
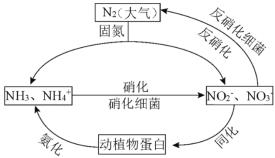
������˵����ȷ����_______������ĸ��ţ�
A.�̵������У�N2ֻ��������
B.����������Ҫ������������
C.�����������������ֲ��˹��̵��Ե�ѭ����ɵ�Ӱ��
D.ͬ�������������У�ʵ���˵�Ԫ����������л���֮���ת��
�ڷ����������У�CH3OH����Ϊ��Ӧ�Ļ�ԭ����1mol��ԭ��ʧȥ6mol���ӡ��뽫�÷�Ӧ�����ӷ���ʽ����������5CH3OH+��NO3��![]() ��_______+��_______+��_______+��_______��_____________
��_______+��_______+��_______+��_______��_____________
��2���о��������������NOx���Ͷ���������������������γ��йء�
����֪��SO2����SO3�ܷ�Ӧ����ʽ��2SO2(g)��O2(g)![]() 2SO3(g)��H����196.6kJ/mol
2SO3(g)��H����196.6kJ/mol
�˷�Ӧ��ͨ������������ɣ�2NO(g)��O2(g)![]() 2NO2(g)��H1����113kJ/mol
2NO2(g)��H1����113kJ/mol
NO2(g)��SO2(g)![]() SO3(g)��NO(g)��H2��_______��
SO3(g)��NO(g)��H2��_______��
��һ���¶��£���2L�����ܱ������г���NO2��SO2��1mol��5min�ﵽƽ�⣬��ʱ������NO2��NO��Ũ��֮��Ϊ1��3����NO2��ƽ��ת������_______��
��3���飨As���ǵ������ڢ�A��Ԫ�أ��仯������Ź㷺����;��
��AsH3���ȶ��Ա�NH3���ȶ���_______������ǿ��������������������ԭ�ӽṹ����ԭ��_______��
�ڳ��������������Ҫ�ɷ�ΪAs2S3���Ƴɽ�״��ͨ��O2����������H3AsO4�͵�����д��������Ӧ�Ļ�ѧ����ʽ_______��
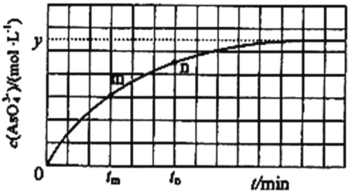
��298Kʱ����20mL3xmolL-1Na3AsO3��20mL3xmolL-1I2��20mLNaOH��Һ��ϣ�������Ӧ��AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l)����Һ��c(AsO43��)�뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ����ƽ��ʱ��Һ��pH=14����÷�Ӧ��ƽ�ⳣ��KΪ_______��
AsO43-(aq)+2I-(aq)+H2O(l)����Һ��c(AsO43��)�뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ����ƽ��ʱ��Һ��pH=14����÷�Ӧ��ƽ�ⳣ��KΪ_______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com