
【题目】下图有机物的正确命名为 ( )
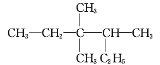
A.2-乙基-3,3-二甲基戊烷B.3,3-二甲基-4-乙基戊烷
C.3,3,4-三甲基己烷D.3,4,4-三甲基己烷
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中①到⑩10种元素,填写下表空白:

(1)在最高价氧化物对应的水化物中,酸性最强的化合物的化学式是______,碱性最强的化合物的化学式是______。![]() 均填化学式
均填化学式![]()
(2)最高价氧化物对应的水化物是两性的元素是______![]() 填元素符号
填元素符号![]() ,写出它的氢氧化物与⑤的氢氧化物反应的离子方程式______。
,写出它的氢氧化物与⑤的氢氧化物反应的离子方程式______。
(3)③⑤⑥三元素形成的简单离子具有相同的电子层结构,它们的离子半径由大到小顺序是![]() 用离子符号表示
用离子符号表示![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下一些氧化物和单质之间可发生如下图所示的反应:其中,氧化物Ⅰ是红棕色固体,氧化物Ⅱ、Ⅲ、Ⅳ在反应条件下都是气体。
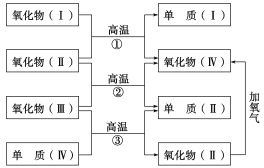
(1)氧化物Ⅰ的化学式是________,氧化物Ⅱ的化学式是________。
(2)反应①的化学方程式是_________;反应②的化学方程式_______;反应③的化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将 1.0 L w mol·L-1 CH3COOH 溶液与 0.1 mol NaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH的变化如图。下列叙述正确的是
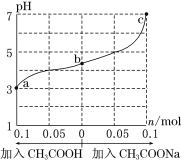
A.b点混合液中c(Na+)>c(CH3COO-)
B.加入CH3COOH过程中,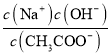 增大
增大
C.c点存在:c(CH3COOH)+c(CH3COO-) =0.1+w
D.a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷在燃烧时放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知: 2C3H8(g)+7O2(g)=6CO(g)+8H2O(1) △H1 =-2741.8 kJmol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0 kJmol-1
(1)反应C3H8 (g)+5O2(g)=3CO2(g)+4H2O(l) △H=____________;
(2)现有1molC3H8在不足量的氧气里燃烧,生成1molCO和2molCO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)CO2(g)+H2(g) △H=+41.2kJmol-1
①下列事实能说明该反应达到平衡的是_____________;
a.体系中的压强不再变化 b.v正( H2) = v逆( CO ) c.混合气体的平均相对分子质量不再变化 d.CO2 的浓度不再发生变化
②5min 后体系达到平衡,经测定,容器中含 0.8 mol H2,则平衡常数K =______;
③其他条件不变,向平衡体系中充入少量CO,则平衡常数K______(填“增大”、“减小”或“不变”)
(3)根据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体 ;燃料电池内部是熔融的掺杂着氧化钆(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-,在电池内部O2-向______极移动(填“正”或“负”);电池的负极电极反应为________。
(4)用上述燃料电池和惰性电极电解足量Mg(NO3)2和NaCl的混合溶液,电解开始后阴极附近的现象为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性重铬酸盐溶液中加入乙醚和H2O2发生反应![]() +4H2O2+2H+=2CrO(O2)2+5H2O。上层出现蓝色,一段时间后上层蓝色逐渐褪去且水相变为绿色(Cr3+)。下列说法错误的是( )
+4H2O2+2H+=2CrO(O2)2+5H2O。上层出现蓝色,一段时间后上层蓝色逐渐褪去且水相变为绿色(Cr3+)。下列说法错误的是( )
A.溶液出现蓝色的反应属于非氧化还原反应
B.乙醚可用乙醇代替
C.该方法既可用于检验H2O2,又可用于检验![]()
D.水层逐渐变为绿色发生的离子反应为4CrO(O2)2+ 12H+=4Cr3++ 6H2O+7O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe与Si形成的合金及铁的配合物用途非常广泛,回答下列问题:
(1)基态Fe2+核外价电子排布式为________;在基态Si原子中,核外存在_____对自旋方向相反的电子。
(2)Fe78Si9B13是一种非晶合金,可通过________方法区分晶体和非晶体。
(3)硅烯是一种具有石墨烯结构的新型二维材料,二硅烯Si2H4分子的几何构型为____,依据电子云的重叠方式可知其所含共价键类型是________。
(4)配合物[Fe(Htrz)3](ClO4) 2 (Htrz为![]() ,1,2,4-三氮唑)
,1,2,4-三氮唑)
①与Fe2+形成配位键的原子是_______;已知分子中的大![]() 键可用
键可用 ![]() 符号表示,其中m代表参与形成大
符号表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数,则配体
键的电子数,则配体![]() 中的大
中的大![]() 键应表示为_____
键应表示为_____
②1,2,4-三氮唑的沸点为260 ℃,环戊二烯(![]() )的沸点为42.5 ℃,前者的沸点比后者大得多,其原因是_____ 。
)的沸点为42.5 ℃,前者的沸点比后者大得多,其原因是_____ 。
(5)砷化镍晶胞的结构如下图所示,1个砷化镍晶胞中含________个As;若六棱柱底边边长为a cm,高为c cm,阿伏加德罗数的值为NA,则砷化镍的密度为____g/cm3。
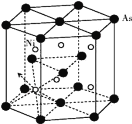
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体[CH3CH(OH)COO]2Fe·3H2O(M=288 g/mol)是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸CH3CH(OH)COOH与FeCO3反应制得.
I.制备碳酸亚铁
(1)利用如图所示装置进行实验。装置中仪器C的名称是____________。

(2)实验开始时,首先关闭活塞2,打开活塞1、3,目的是________________________;关闭活塞1,反应一段时间后,关闭活塞_________,打开活塞___________,观察到B中溶液进入到C中,C中产生沉淀和气体。生成FeCO3的离子方程式为__________。
(3)装置D的作用是___________________。
Ⅱ.乳酸亚铁晶体的制备及纯度测定
将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应。然后再加入适量乳酸,从所得溶液中获得乳酸亚铁晶体。
(4)加入少量铁粉的作用是______________________________。
(5)用KMnO4滴定法测定样品中Fe2+的量进而计算纯度时,发现结果总是大于100%,其主要原因是____________________________________________。
(6)经查阅文献后,改用Ce(SO4)2标准溶液进行滴定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760 g样品,溶解后进行必要处理,用容量瓶配制成250 mL溶液,每次取25.00 mL,用0.1000 mol·L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表所示:

则产品中乳酸亚铁晶体的纯度为________%(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.同温同压下,1 mol N2与1 mol CO可能具有不同的体积
B.同温同压下,二氧化碳与笑气(化学式为N2O)的密度相同
C.质量相同的O2与O3,一定具有相同的原子数
D.28 g CO与1 mol CO一定具有相同的碳原子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com