解答:
解:A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,A元素的原子半径最小,则A为氢元素,B元素原子的最外层电子数是内层电子数的2倍,则B为碳元素,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,则C为氮元素,D与E同主族,E元素原子的最外层电子数比次外层电子数少2,则D为氧元素,E为硫元素,因为F为短周期元素,原子序数大于硫,所以F为氯元素,
根据以上分析可知:A为H元素、B为C元素、C为N元素、D为O元素、E为S元素、F为Cl元素,
(1)B为C元素,核电荷数为6,最外层含有4个电子,其原子结构示意图为:
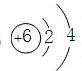
,
故答案为:
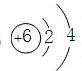
;
(2)元素D的单质与金属钠反应生成的化合物X可作潜水面具中的供氧剂,则化合物X为Na
2O
2,过氧化钠中含有离子键和非极性共价键,
故答案为:Na
2O
2;离子键、非极性共价键;
(3)B为C元素、D为O元素,C和O形成的两种化合物为CO和二氧化碳,其中CO有毒,CO分子中含有两个原子、14个电子,与氮气互为等电子体,氮气分子中存在氮氮三键,则CO中存在碳氧三键,一氧化碳的结构式为:C≡O;
二氧化碳为直线型结构,是由极性键构成的非极性分子,
故答案为:C≡O;非极性;
(4)D为O元素、E为S元素,O和S两种元素相比较,其原子得电子能力较强的是氧,要证明这一结论,
a.单质的沸点与得电子能力无关,故a错误;
b.二者形成的化合物中,O元素的原子显负价,说明氧得电子能力强,故b正确;
c.得电子能力越强,气态氢化物越稳定,故c正确;
d.氢化物的水溶液的酸性不能说明得电子能力强弱,故d错误;
故答案为:氧;bc;
(5)A为H元素、B为C元素、D为O元素,元素A、D、E与钠元素可形成两种酸式盐为硫酸氢钠和亚硫酸氢钠,这两种酸式盐在水溶液中反应生成硫酸钠、二氧化硫气体和水,反应的离子方程式是:H
++HSO
3-═SO
2↑+H
2O,
故答案为:H
++HSO
3-═SO
2↑+H
2O;
(6)元素C为N,元素C的氢化物为氨气,氨气易液化是因为氨气分子间存在氢键,中心原子(N)半径较小,对H原子吸引能力强,可以吸引其它氨气分子的H原子;
氨气易溶于水是基于相似相容原理,氨气和水都是极性分子,而且都可以形成氢键,故而加大的溶解度,
故答案为:氨气易液化是由于氨气分子中存在氢键,易溶于水是氨气为极性分子,极性分子易溶于极性溶剂水,且可以形成氢键.

 ,
,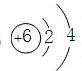 ;
; 

 名校课堂系列答案
名校课堂系列答案