
| A. | 摩尔质量就等于物质的式量 | |
| B. | 摩尔质量就是物质式量的6.02×1023倍 | |
| C. | HNO3的摩尔质量是63g | |
| D. | H2SO4和H3PO4的摩尔质量相等 |
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
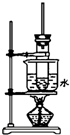 如图是实验室制取酚醛树脂的装置图(烧杯底部垫有石棉网).
如图是实验室制取酚醛树脂的装置图(烧杯底部垫有石棉网).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下11.2 L氢气所含的原子数目为NA | |
| B. | 18 g水所含的氢原子数目为NA | |
| C. | 2.3 g金属钠转化为Na2O和Na2O2的混合物时失去的电子数为0.1NA | |
| D. | 物质的量浓度为0.5 mol•L-1 的MgCl2溶液,含有的Cl- 数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲烷与丙烷互为同系物 | |
| B. | 甲烷的一氯代物只有一种结构证明甲烷是正四面体结构而非平面正方形结构 | |
| C. | 甲烷、乙烷、丙烷中的化学键都是极性共价键 | |
| D. | 乙烷和氯气在光照的条件下可发生取代反应,生成多种氯代烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上电解熔融Al2O3制备金属铝 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 金属锌与稀硫酸反应制取氢气,粗锌比纯锌反应速率快 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com