
 (Ⅰ)如图1,X和Y均为石墨电极:
(Ⅰ)如图1,X和Y均为石墨电极:| 充电 |
| 放电 |
| ||
| ||
| 0.025×2mol |
| 0.5L |


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、(
| ||
B、(
| ||
C、(
| ||
D、(
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 滴定前读数 | 滴定后读数 |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 21.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
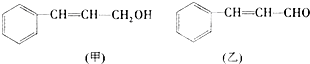
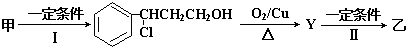
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体硅具有半导体性质,可用于生产光导纤维 |
| B、H2O2是一种绿色氧化剂,可与酸性高锰酸钾作用产生O2 |
| C、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D、二氧化硫具有漂白性,铵不可用于食品漂白 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、则此过程中参加反应的铁的质量是14g |
| B、析出铜物质的量是0.25mol |
| C、反应后溶液中溶质物质的量浓度:c(CuSO4)=1.5mol/L |
| D、反应后溶液中溶质物质的量浓度:c(FeSO4)=1.5mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com