
【题目】某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应:
实验:向盛有2mL0.1mol/LBa(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色。
探究1:白色沉淀产生的原因。
(1)白色沉淀是___。
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2。
①支持甲同学观点的实验证据是_____________________________________。
②依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式___________________________________。
③乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
实验操作 | 实验现象 |
向2mL____mol/L____溶液(填化学式)中通入SO2 | ____________ |
探究2:在氧化SO2的过程中,NO3-和O2哪种微粒起了主要作用。
实验操作 | 实验数据 |
向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,通入SO2,用pH传感器测定溶液pH随时间(t)的变化曲线 |
图1:向BaCl2(无氧)溶液中通入SO2 |
向烧杯中分别加入25mL0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线。 |
图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2 |
(3)图1,在无氧条件下,BaCl2溶液pH下降的原因是______________________________。
(4)图2,BaCl2溶液中发生反应的离子方程式为_________。
(5)依据上述图像你得出的结论是________,说明理由_________________________
【答案】BaSO4 液面上方略显浅棕色 3Ba2++2NO3-+3SO2+2H2O=BaSO4↓+2NO+4H+ 0.1 BaCl2 试管内有白色沉淀产生 SO2+H2O![]() H2SO3 H2SO3
H2SO3 H2SO3![]() HSO3—+H+ 2Ba2++2SO2+O2+3H2O
HSO3—+H+ 2Ba2++2SO2+O2+3H2O![]() 2BaSO4↓+4H+ 在氧化SO2的过程中,O2起了主要作用 在BaCl2溶液中起氧化作用的是O2,在Ba(NO3)2溶液中起氧化作用的是O2和NO3-,而图2中,分别向BaCl2、Ba(NO3)2溶液中通入SO2,pH变化趋势,幅度接近,因此起氧化作用的主要O2
2BaSO4↓+4H+ 在氧化SO2的过程中,O2起了主要作用 在BaCl2溶液中起氧化作用的是O2,在Ba(NO3)2溶液中起氧化作用的是O2和NO3-,而图2中,分别向BaCl2、Ba(NO3)2溶液中通入SO2,pH变化趋势,幅度接近,因此起氧化作用的主要O2
【解析】
(1)SO2与Ba(NO3)2溶液的反应,根据元素守恒可知,白色沉淀应为BaSO4;
(2)①NO3-氧化了SO2,则硝酸根被还原成一氧化氮,一氧化氮可以再被氧化成二氧化氮,使得液面上方略显浅棕色;
②Ba(NO3)2溶液与SO2反应生成硫酸钡和一氧化氮,根据元素守恒和电荷守恒书写离子方程式;
③乙同学要证明了自己的推测正确,所用试剂应与甲同学一样,这样才可以做对比,反应后会生成硫酸钡沉淀;
(3)二氧化硫溶于水生成亚硫酸,亚硫酸会使溶pH值下降;
(4)图2,BaCl2溶液中通入二氧化硫,与图1相比酸性明显增加,说明氧气参加了反应,生成了硫酸钡和盐酸;
(5)在BaCl2溶液中起氧化作用的是O2,在Ba(NO3)2溶液中起氧化作用的是O2和NO3-,而图2中,分别向BaCl2、Ba(NO3)2溶液中通入SO2,pH变化趋势、幅度接近,据此答题。
(1)SO2与Ba(NO3)2溶液的反应,根据元素守恒可知,白色沉淀应为BaSO4;
(2)①NO3-氧化了SO2,则硝酸根被还原成一氧化氮,一氧化氮可以再被氧化成二氧化氮,使得液面上方略显浅棕色,所以支持甲同学观点的实验证据是液面上方略显浅棕色;
②Ba(NO3)2溶液与SO2反应生成硫酸钡和一氧化氮,反应的离子方程式为3Ba2++2NO3-+3SO2+2H2O=3BaSO4↓+2NO+4H+;
③乙同学要证明了自己的推测正确,所用试剂应与甲同学一样,这样才可以做对比,所以所用试剂为0.1mol/LBaCl2溶液,可以看到有白色沉淀出现;
(3)在无氧条件下,二氧化硫溶于水生成亚硫酸,亚硫酸会使溶pH值下降,反应的方程式为SO2+H2OH2SO3,H2SO3HSO3-+H+;
(4)图2,BaCl2溶液中通入二氧化硫,与图1相比酸性明显增加,说明氧气参加了反应,生成了硫酸钡和盐酸,反应的离子方程式为2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+;
(5)比较图1和图2可知,在氧化SO2的过程中,O2起了主要作用,因为在BaCl2溶液中起氧化作用的是O2,在Ba(NO3)2溶液中起氧化作用的是O2和NO3-,而图2中,分别向BaCl2、Ba(NO3)2溶液中通入SO2,pH变化趋势、幅度接近。


科目:高中化学 来源: 题型:
【题目】锌元素对婴儿及青少年的智力和身体发育有重要的作用,被称为生命火花。利用恒电势电解NaBr溶液间接将葡萄糖[CH2OH(CHOH)4CHO]氧化为葡萄糖酸[CH2OH(CHOH)4COOH],进而制取葡萄糖酸锌,装置如图所示,下列说法错误的是( )
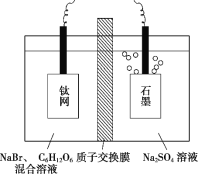
A.钛网与直流电源的正极相连,发生还原反应
B.石墨电极的反应为2H2O+2e-=H2↑+2OH-
C.电解过程中硫酸钠溶液浓度保持不变
D.生成葡萄糖酸的化学方程式为CH2OH(CHOH)4CHO+Br2+H2O=CH2OH(CHOH)4COOH+2HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2(体系均为酸性条件),它们使用的药品和装置如图所示:

(1)SO2气体还原Fe3+后的所有产物有___________(填离子符号),参加反应的SO2和Fe3+的物质的量之比是______________;
(2)写出装置B中反应的离子方程式________________________;装置C的作用是________________________。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、然后干燥,在这一系列操作中没有用到的仪器是____________
A、蒸发皿 B、石棉网 C、漏斗 D、玻璃棒 E、坩埚
(4)在上述装置中通入过量的SO2,为了验证SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分为三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去;
方案②:往第二份试液中加入KSCN溶液(硫氰化钾,遇到Fe3+时溶液变成血红色),溶液不变红,再加入某种氧化剂,溶液变红;
方案③:往第三份试液中加入用盐酸酸化的BaCl2溶液,产生白色沉淀。
上述方案不合理的是_______________,原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
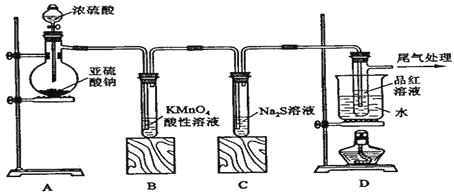
请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年我国首艘使用了钛合金材料的国产航母下水。钛(Ti)常温下与酸、碱均不反应,但高温下能被空气氧化。由钛铁矿(主要成分是FeO和TiO2)提取金属钛的主要工艺流程如图,下列说法错误的是

A. 步骤I中碳作还原剂
B. 步骤II中未发生氧化还原反应
C. 步骤III需在氩气环境中进行,防止金属被空气氧化
D. 可用稀硫酸除去金属钛中的少量镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①标准状况下,6. 02×1023个分子所占的体积约是22. 4 L
②0. 5 mol H2所占体积为11. 2 L
③标准状况下,1 mol H2 O的体积为22.4 L
④标准状况下,28 g CO与N2的混 合气体的体积约为22. 4 L
⑤各种气体的气体摩尔体积都 约为22. 4 L/mol
⑥标准状况下,体积相同的气体的分子数相同
A.①③⑤B.④⑥C.③④⑥D.①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是温度和压强对反应X+Y![]() 2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
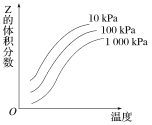
A.上述可逆反应的正反应为放热反应B.X、Y、Z均为气态
C.X和Y中最多只有一种为气态,Z为气态D.上述反应的逆反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4 L水含有的水分子数为NA
B. 常温常压下,22 g CO2含有的CO2分子数为0.5NA
C. 标准状况下,32 g O2和CO2的混合气体含有的氧原子数为2NA
D. 40 g NaOH溶解在1 L水中,得到溶液的物质的量浓度为1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水体中硝酸盐造成的污染已成为突出的环境问题。某课题组研究了去除不同各种水体中NO3-的方法。
(1)用铝粉去除饮用水中NO3-的一种方案如下:
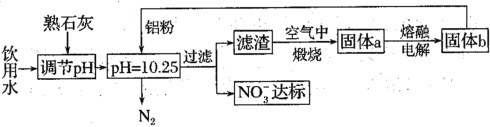
①用熟石灰而不用NaOH调节pH的主要原因是___。在调节pH时,若pH过大或过小都会造成Al的利用率降低。写出pH过大造成Al利用率降低的离子方程式___。
②在加入铝粉去除NO3-的反应中,氧化产物和还原产物的物质的量之比为___。
(2)用铁粉处理pH=2.5的含NO3-废水,测得溶液中相关离子浓度、pH随时间的变化关系如图(部分副反应产物略去):
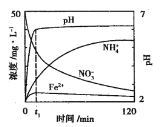
①t1时刻前,该反应的离子方程式为___。
②研究表明:铁粉还原含NO3-废水时,加入活性碳粉可以提高去除NO3-的速率,可能的原因是___。
(3)用Pt作电极电解含NO3-的酸性废水,原理如图。N为电源的___(选填“正”或 “负”)极,与直流电源M端相连的Pt电极上的电极反应式为___。
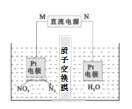
(4)课题组以钛基氧化物涂层材料为惰性阳极、碳纳米管修饰的石墨为阴极,控制一定条件,电解含大量NO3-、SO42-的废水,可使NO3-变为NH4+。研究发现:其他条件不变,废水中加一定量NaCl,去除NH4+的效果明显提高,溶液中氮元素含量显著降低,可能的原因是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com