
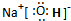 ,所含有的化学键有离子键、极性共价键;它属于离子化合物(填“离子”或“共价”).
,所含有的化学键有离子键、极性共价键;它属于离子化合物(填“离子”或“共价”). 分析 X、Y、Z、E、F为五种短周期元素,原子序数依次递增,X+只含有一个质子,则X为H元素;Y的最高正化合价、最低负化合价绝对值相等,Y处于ⅣA族,在同族元素中其氢化物最稳定,则Y为C元素;Z的原子核内质子数是Y的最外层电子数的2倍,则Z的质子数为8,则Z为O元素;F与Z同主族,则F为S元素;E与X同主族,E的原子序数等于O元素,故E为Na元素,据此进行解答.
解答 解:X、Y、Z、E、F为五种短周期元素,原子序数依次递增,X+只含有一个质子,则X为H元素;Y的最高正化合价、最低负化合价绝对值相等,Y处于ⅣA族,在同族元素中其氢化物最稳定,则Y为C元素;Z的原子核内质子数是Y的最外层电子数的2倍,则Z的质子数为8,则Z为O元素;F与Z同主族,则F为S元素;E与X同主族,E的原子序数等于O元素,故E为Na元素,
(1)由上述分析可知,Y为C元素、Z为O元素、F为S元素,
故答案为:C;O;S;
(2)电子层越多,原子半径越大,电子层相同时,核电荷数越小,原子半径越大,则原子半径最大的为Na,原子半径最小的为H,
故答案为:Na;H;
(3)H、O、Na形成化合物为NaOH,其电子式为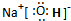 ,所含有的化学键有离子键、极性共价键,属于离子化合物,
,所含有的化学键有离子键、极性共价键,属于离子化合物,
故答案为: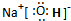 ;离子键、极性共价键;离子.
;离子键、极性共价键;离子.
点评 本题考查了位置结构与性质关系的综合应用,题目难度中等,涉及元素推断、电子式、化学键等知识,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题有利于提高学生的分析能力及灵活应用能力.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2分子的球棍模型: | |
| B. | COCl2的电子式: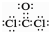 | |
| C. | 质子数为6、质量数为14的原子:${\;}_{6}^{14}$N | |
| D. | 熔融状态下硫酸氢钾的电离方程式:KHSO4(熔融)→K++H++SO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁是人体健康、植树生长所必须的元素之一,缺铁时可用补充FeSO4的方法补铁 | |
| B. | 在采煤作业中,把炸药和干冰放在一起,既能增强爆炸威力,又能防止火灾 | |
| C. | 氢氧燃料电池已用于航天飞机,燃料电池的能量转化率理论上可达100% | |
| D. | 聚乙烯塑料可用于制作餐具 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
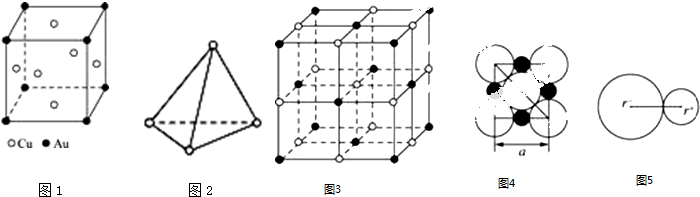
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
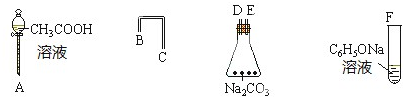

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
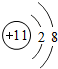 ;
;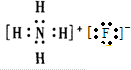 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 变成血红色 | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入K3[Fe(CN)6],振荡 | 产生蓝色沉淀 | 存在Fe2+ |
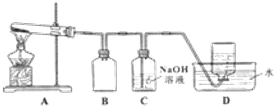
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硫酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
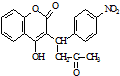
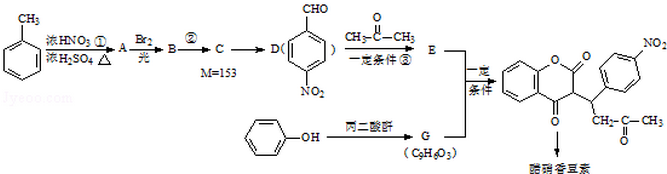 已知:R1-CHO
已知:R1-CHO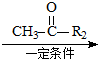 R1-CH=
R1-CH= +H2O
+H2O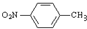 ;反应②的反应类型取代反应.
;反应②的反应类型取代反应.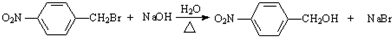 .
.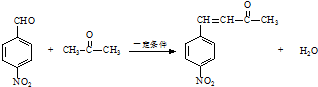 .
.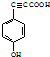 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com