


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
| A、若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| B、达到化学平衡时,4v正(O2)=5v逆(NO) |
| C、达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D、化学反应速率关系是:v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
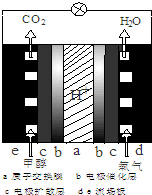 以甲醇为替代燃料是解决我国石油资源短缺的重要措施.
以甲醇为替代燃料是解决我国石油资源短缺的重要措施.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、砹易溶于某些有机溶剂 |
| B、砹化氢很不稳定易分解 |
| C、砹是有色气体 |
| D、砹化银不溶于水或稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
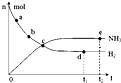 科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A、点a的正反应速率比点b的大 |
| B、点c处反应达到化学平衡状态 |
| C、点d和点e处的n(N2)不相同 |
| D、点e反应达到化学平衡状态,反应停止 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com