
已知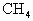 (气)+
(气)+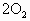 (气)→
(气)→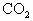 (气)+
(气)+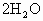 (液);△H=-890kJ,标准状况下1.12L甲烷完全燃烧后能生成________mol
(液);△H=-890kJ,标准状况下1.12L甲烷完全燃烧后能生成________mol![]() 和________g液态水,需要标准状况下的空气________L.
和________g液态水,需要标准状况下的空气________L.
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| 反应过程 | 化学方程式 | △H(kJ?mol-1) |
| 甲醇合成反应 | 2H2(g)+CO(g)=CH3OH(g) | -90.8 |
| 水煤气变换反应 | CO(g)+H2O(g)═CO2(g)+H2(g) | -41.3 |
| 甲醇脱水反应 | 2CH3OH(g)=CH3OCH3(g)+H2O(g) | -23.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:021
已知键能是拆开1 mol化学键所吸收的能量,或形成1 mol化学键所放出的能量。根据热化学方程式:S(固)+O2(气)=SO2(气)+297.23kJ,则下列说法正确的是( )
A.S(气)+O2(气)=SO2(气)+Q, Q>297.23kJ
B.S(气)+O2(气)=SO2(气)+Q, Q<297.23kJ
C.1mol SO2的键能总和<1 mol硫与1 mol O2的键能总和
D.1mol SO2的键能总和>1 mol硫与1 mol O2的键能总和
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:021
A.S(气)+O2(气)=SO2(气)+Q, Q>297.23kJ
B.S(气)+O2(气)=SO2(气)+Q, Q<297.23kJ
C.1mol SO2的键能总和<1 mol硫与1 mol O2的键能总和
D.1mol SO2的键能总和>1 mol硫与1 mol O2的键能总和
查看答案和解析>>
科目:高中化学 来源: 题型:
(6分)(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ/mol,H—H键的键能是436.0 kJ/mol;由N2和H2合成1 mol NH3时可放出46.2 kJ的热量。则N—H键的键能是_______________________。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学方程式:
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g)ΔH=-24.8 kJ/mol ①
3Fe2O3(s)+CO(g) = 2Fe3O4(s)+CO2(g)ΔH=-47.2 kJ/mol ②
Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g)ΔH=+640.5 kJ/mol ③
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学方程式______________________________。
(3)已知两个热化学方程式:
C(s)+O2(g)=CO2(g) △H= ―393.5kJ/mol
2H2(g)+O2(g)=2H2O(g) △H= ―483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是 .
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省焦作市修武一中分校高二上学期期中考试化学试卷 题型:填空题
(6分)(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ/mol,H—H键的键能是436.0 kJ/mol;由N2和H2合成1 mol NH3时可 放出46.2 kJ的热量。则N—H键的键能是_______________________。
放出46.2 kJ的热量。则N—H键的键能是_______________________。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学方程式:
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol ①
3Fe2O3(s)+CO(g) = 2Fe3O4(s)+CO2(g) ΔH=-47.2 kJ/mol ②
Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) ΔH=+640 .5 kJ/mol ③
.5 kJ/mol ③
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学方程式______________________________。
(3)已知两个热化学方程式:
C(s)+O2(g)=CO2 (g) △H= ― 393.5kJ/mol
(g) △H= ― 393.5kJ/mol
2H2(g)+O2(g )=2H2O(g) △H= ― 483.6kJ/mol
)=2H2O(g) △H= ― 483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com