
| A. | Mg2++2OH-═Mg(OH)2↓ Mg(NO3)2+Ba(OH)2═Mg(OH)2↓+Ba(NO3)2 | |
| B. | Fe+Cu2+═Fe2++Cu Fe+CuO═FeO+Cu | |
| C. | Ag++Cl-═AgCl↓ Ag2SO4+2HCl═2AgCl↓+H2SO4 | |
| D. | CO2+2OH-═CO32-+H2O CO2+2NH3•H2O═(NH4)2CO3+H2O |
分析 A.Mg(NO3)2+Ba(OH)2═Mg(OH)2↓+Ba(NO3)2反应实质镁离子与氢氧根离子反应生成氢氧化镁;
B.氧化铜与铁不反应;
C.硫酸银为微溶物,应保留化学式;
D.一水合氨为弱碱,应保留化学式.
解答 解:A.Mg(NO3)2+Ba(OH)2═Mg(OH)2↓+Ba(NO3)2反应实质镁离子与氢氧根离子反应生成氢氧化镁,离子方程式:Mg2++2OH-═Mg(OH)2↓,故A正确;
B.氧化铜与铁不反应,故B错误;
C.Ag2SO4+2HCl═2AgCl↓+H2SO4,离子方程式:Ag2SO4(s)+2Cl-(aq)═2AgCl(s)+SO42-(aq),故C错误;
D.CO2+2NH3•H2O═(NH4)2CO3+H2O,离子方程式:CO2+2NH3•H2O═2NH4++CO32-+H2O,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确物质的性质及离子方程式书写方法是解题关键,注意反应遵循客观事实,题目难度不大.


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 4 mol A+2 mol B | B. | 3 mol C+2 mol D | ||
| C. | 1 mol B+3 mol C+1 mol D | D. | 2 mol A+1 mol B+3mol C+1 mol D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当温度一定时,不同的起始条件下可逆反应建立平衡状态时,平衡常数和转化率一定是定值 | |
| B. | 依据焓判据:NH4HCO3受热分解可自发进行 | |
| C. | 大多数化学反应在一定条件下都有一定的限度 | |
| D. | FeCl3与KSCN反应达到平衡时,向其中滴加少量KCl溶液,则溶液颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | 化学变化 | 物理变化 |
| B | 氧化还原反应 | 分解反应 |
| C | 氧化还原反应 | 化合反应 |
| D | 中和反应 | 复分解反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,萃取剂的密度不一定比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL 2 mol/LMgCl2溶液 | B. | 1000mL 2.5 mol/L NaCl溶液 | ||
| C. | 300mL 5 mol/L KCl溶液 | D. | 250mL 1 mol/L FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
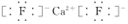 ;Y2与NaOH溶液反应的产物之一是OY2,该反应的离子方程式为2F2+2OH-=OF2↑+2F-+H2O.
;Y2与NaOH溶液反应的产物之一是OY2,该反应的离子方程式为2F2+2OH-=OF2↑+2F-+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com