
| A. | 0.045mol/L | B. | 0.036mol/L | C. | 0.026mol/L | D. | 0.030mol/L |
分析 HCl气体溶于水,所得溶液的体积等于烧瓶的容积等于HCl的体积,令体积为1L,根据n=$\frac{V}{{V}_{m}}$计算二氧化氮的物质的量,再根据c=$\frac{n}{V}$计算所得盐酸的浓度.
解答 解:令HCl气体的体积为1L,则HCl的物质的量为$\frac{1L}{22.4L/mol}$=$\frac{1}{22.4}$mol,
HCl气体溶于水,所得溶液的体积等于HCl的体积,所得盐酸的物质的量浓度=$\frac{\frac{1}{22.4}mol}{1L}$≈0.045mol/L,
故选A.
点评 本题考查物质的量浓度的有关计算,关键是明确溶液体积等于氯化氢的体积,旨在考查学生对物质的量浓度定义的理解,难度不大.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 CH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ | |
| B. | “NO2球”浸泡在冷水中,颜色变浅:2NO2(g)??N2O4(g)△H<0 (红棕色) (无色) | |
| C. | 铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO${\;}_{3}^{-}$═3Fe3++2NO↑+4H2O | |
| D. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO${\;}_{3}^{2-}$+H2O?HCO${\;}_{3}^{-}$+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中盐酸电离出的c(H+)与水电离出的c(H+)之比为1010:1 | |
| B. | 向该溶液中加入等体积pH为12的氨水恰好完全中和 | |
| C. | 将10mL该溶液稀释至100mL后,pH小于3 | |
| D. | 该溶液中由水电离出的c(H+)水×c(OH-)水=1×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
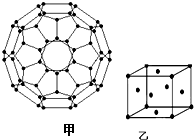 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
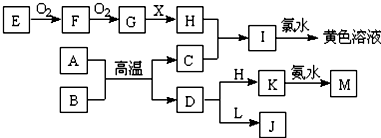
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Cl | B. | CH2Cl2 | C. | CCl4 | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO3与BaSO4沉淀 | B. | BaSO3沉淀 | ||
| C. | BaSO4沉淀 | D. | 无法得到沉淀物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
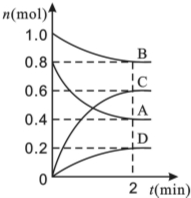 T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示,已知:物质A、B、C均为气态,D为固态,正反应时吸热反应,根据要求回答下列问题:
T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示,已知:物质A、B、C均为气态,D为固态,正反应时吸热反应,根据要求回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com